IF 26.8!液态金属纳米颗粒介导的线粒体损伤增强了癌症疫苗治疗中的免疫原性细胞死亡
QQ学术交流群:1092348845
详细介绍
本文精选
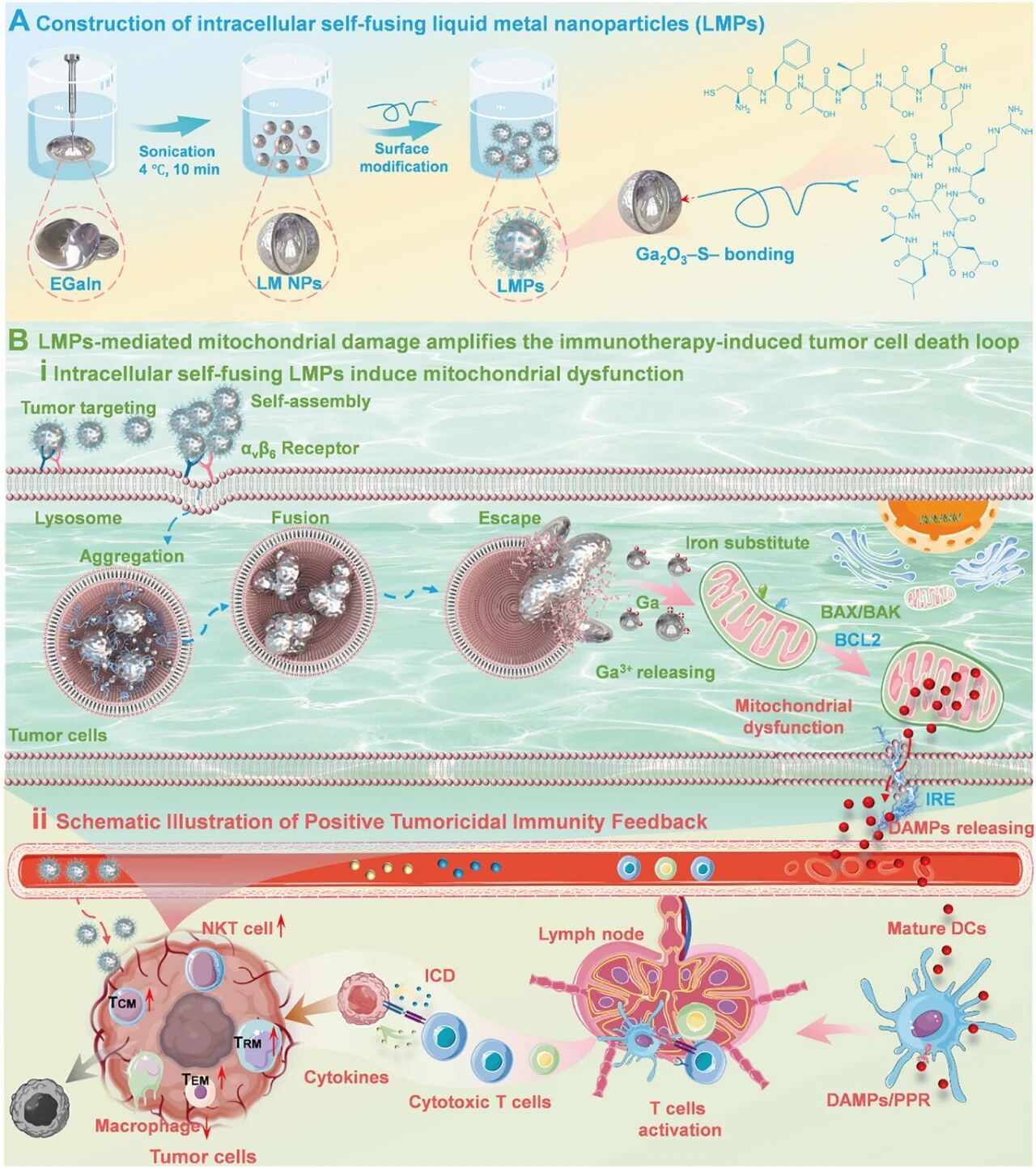
由于免疫抑制性肿瘤微环境(TME)和肿瘤抗原的低免疫原性,癌症疫苗面临局限性。由线粒体功能障碍触发的免疫原性细胞死亡(ICD)是一种有前景的策略,可以增强肿瘤抗原释放和免疫激活。然而,主动扩增线粒体损伤诱导的 ICD 仍然具有挑战性。在这项研究中,我们开发了一种疫苗,其中液态金属纳米颗粒(LMPs)针对肿瘤细胞,在细胞表面进行自我组装和聚集以实现高效摄取,细胞内融合以延长保留时间,并通过铁替代途径释放 Ga 3+离子诱导线粒体损伤,从而触发 ICD。结合不可逆电穿孔(IRE),该方法介导持久的肿瘤特异性免疫疗法。具体来说,LMPs 针对肿瘤细胞整合素αvβ6,启动自组装和聚集,从而实现高效的细胞内化。在酸性溶酶体环境中,LMPs 发生融合并部分逸出至细胞质中,从而实现细胞内长期保留和持续释放 Ga 3+离子。释放的 Ga 3+破坏线粒体结构,并通过铁替代抑制电子运输,导致明显的线粒体损伤。协同的 IRE 和 LMPs 能增加线粒体损伤相关 DAMP 和肿瘤抗原的释放,驱动强健的 ICD 和长期系统性抗肿瘤免疫。这一双模态策略为癌症免疫治疗中纳米材料驱动的 ICD 扩增提供了蓝图。
创新点
1.研究创新性地构建了兼具高效靶向、细胞内自组装与长期滞留功能的液态金属纳米疫苗,其通过特异性靶向整合素αvβ6实现肿瘤细胞膜表面的可控聚集,从而显著提升了细胞摄取效率,这为解决纳米载体靶向递送效率低的普遍难题提供了新思路。
2.提出了“细胞内融合与离子缓释”的新机制,液态金属纳米颗粒在酸性溶酶体环境中发生融合并部分逃逸至胞质,实现了载体在细胞内的长期驻留与Ga³⁺离子的持续释放,这种设计巧妙地将载体行为与细胞内微环境响应相结合,突破了传统纳米颗粒易被快速清除的限制。
3.开创了“铁替代诱导线粒体损伤”与物理消融(IRE)协同扩增免疫原性细胞死亡的协同模式,通过Ga³⁺破坏线粒体电子传递链,从代谢根基上触发强烈的内源性危险信号释放,并与IRE介导的物理性抗原释放相结合,实现了对肿瘤免疫抑制微环境的双重逆转,为癌症疫苗的效能提升提供了全新途径。
原文链接
Liquid Metal Nanoparticles-Mediated Mitochondrial Damage Enhances Immunogenic Cell Death for Cancer Vaccine Therapy
Advanced Materials ( IF 26.8 )
Pub Date : 2026-01-05
DOI: 10.1002/adma.202520580
Yuxia Qi, Zhongyang Yu, Jie Zhang, Chi Zhang, Xiaoshuai Wang, Fan Yang, Yunlong Bai, Jun‐Xiao Yuan, Minghui Guo, Dawei Wang, Kaiwen Hu, Tian Zhou, Lei Wang, Wei Rao
- 上一款: IF 16!通过表型特异性纳米探针辅助表型筛
- 下一款: Biomaterials | 用仿生纳米颗粒

 mxene 学术专题
mxene 学术专题