ACS Nano | 含硒纳米尺度氢键有机框架纳米酶,用于脑缺血再灌注损伤的多酶级联抗氧化靶向治疗
QQ学术交流群:1092348845
详细介绍
无金属氢键有机框架(HOFs)是通过有机构件氢键形成的多孔材料,在生物医学应用中具有优异的生物相容性和酶兼容性。然而,利用 HOFs 制造用于脑缺血再灌注损伤(CIRI)治疗的多酶级联抗氧化纳米酶仍具挑战性。这里合成了含硒的纳米 HOFs(SeHOFs),作为谷胱甘肽过氧化物酶模拟体,原位包裹超氧化物歧化酶(SOD)和过氧化氢酶(CAT),形成混合级联抗氧化系统(SeHOF@CAT@SOD)。SeHOFs 表现出增强的催化活性,保持酶功能,并能保护其免受温度、蛋白水解和变性。无金属纳米酶展现出优异的生物相容性和级联催化效能,能够清除活性氧物种,并在体外减少细胞凋亡和铁剥坏。肽修饰增强梗塞部位积累,有效减少 CIRI 模型中的梗塞体积、氧化应激、神经元凋亡、铁消亡和炎症。本研究强调了纳米 HOF 作为在缺血性卒中治疗中先进治疗性纳米酶开发支架的潜力。

为对抗脑卒中提供新思路,科学家们最近开发了一种新型纳米酶,可用于治疗脑缺血再灌注损伤,该研究发表在学术期刊《ACS Nano》上。这项工作的核心是利用含硒氢键有机框架构建了一种多酶级联抗氧化纳米酶系统,该系统不仅能高效清除有害的活性氧,还能精准靶向脑缺血区域,在动物模型中显著减轻了脑损伤并促进神经功能恢复,展现出良好的治疗潜力。
脑卒中是目前全球致死和致残的主要原因之一,其中缺血性脑卒中占比最高。临床上的早期再灌注治疗虽能恢复血流,但随之产生的过量活性氧会引发再灌注损伤,加剧脑细胞死亡。传统的抗氧化疗法因稳定性差、难以穿越血脑屏障、靶向性不足等问题,效果受限。为此,研究团队将目光投向了一种新兴材料——氢键有机框架。
氢键有机框架是一种通过氢键自组装形成的多孔材料,具有良好的生物相容性和酶兼容性,且不含金属离子,避免了潜在的生物毒性。在这项研究中,团队合成了含硒的纳米氢键有机框架,它本身可模拟谷胱甘肽过氧化物酶的活性,同时在其孔隙中原位封装了天然的超氧化物歧化酶和过氧化氢酶,从而构建出一个集成人工酶与天然酶的多酶级联抗氧化系统。
实验表明,该纳米系统能有效维持酶的活性,并在高温、蛋白酶和变性剂等恶劣条件下保护酶结构。在细胞层面,该系统展现出优异的生物相容性和活性氧清除能力,并能显著抑制由缺氧缺糖再灌注引起的细胞凋亡和铁死亡。更关键的是,研究团队通过在纳米材料表面修饰两种靶向肽,使其能够主动穿越血脑屏障,并特异性地聚集在大脑缺血病灶区域。
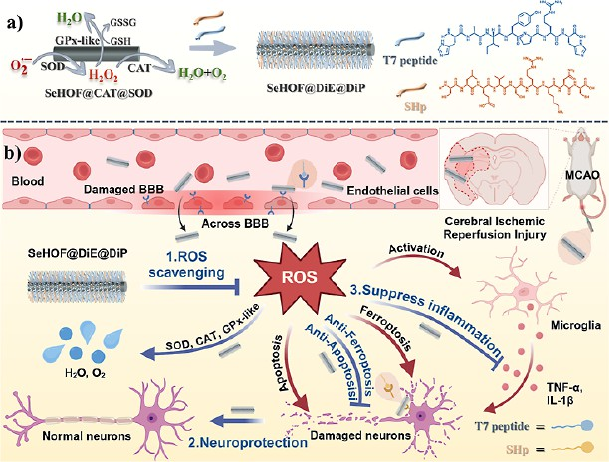
在模拟脑缺血再灌注损伤的大鼠模型中,靶向后的纳米酶系统成功在梗死区域富集,有效减少了梗死体积,改善了神经功能缺损评分。进一步机制研究揭示,该纳米系统通过抑制细胞凋亡、铁死亡以及神经炎症等多重途径,发挥了综合性的神经保护作用。此外,短期体内安全性评估也未发现明显的毒副作用。
这项研究不仅证实了氢键有机框架作为多酶载体在生物医学领域的巨大潜力,更重要的是,它为缺血性脑卒中后的神经保护治疗提供了一种全新的靶向治疗策略。这种基于纳米材料的级联抗氧化系统,有望为未来开发更高效、更安全的脑卒中治疗药物开辟新的道路。
参考消息:
https://www.x-mol.com/paper/2008081716573552640/t?adv
- 上一款: Advanced Science | 毒力选
- 下一款: Biomaterials | 用仿生纳米颗粒

 mxene 学术专题
mxene 学术专题