切换金纳米颗粒的过氧化物酶活性以检测蛋白水解生物标志物
QQ学术交流群:1092348845
详细介绍
| 模仿天然酶的复杂性和功能的纳米颗粒可以充当有效的过氧化物酶,催化3,3‘,5‘5-四甲基联苯胺(TMB)的氧化,生成氧化的蓝色产物。 | |
| 贝尔法斯特女王大学全球食品安全研究所的科学家首次发现,当金纳米颗粒(AuNPs)的表面被酪蛋白包被时,AuNPs的内在过氧化物酶模拟活性被强烈抑制,即高达77.1%,归因于表面屏蔽作用。 | |
| 然而,在蛋白酶的存在下,酪蛋白屏蔽层被降解,从而允许恢复AuNP的过氧化物酶模拟活性,从而检测蛋白水解酶。 | |
| 蛋白酶参与所有生命功能,突显了其在许多疾病的进展和微生物生长中的关键作用。用于蛋白酶检测的常规方法缓慢,缺乏低水平检测所需的灵敏度,并且不能在现场使用。这些局限性阻碍了这些检测方法的应用,无法提供食物变质,感染和疾病状态的早期迹象。 | |
| 为了克服这些限制,贝尔法斯特女王大学全球食品安全研究所的 Cuong Cao博士研究小组开发了一种利用金纳米颗粒特性的简化方法。 | |
| 结果强调了一种灵敏,快速且经济高效的纳米传感器,可用于牛奶和尿液中的蛋白酶检测。这项工作最近在Nano Research(“用于确定蛋白水解生物标志物的异常可开关的过氧化物酶模拟纳米酶”)上以开放获取的形式发表。 | |
|
|
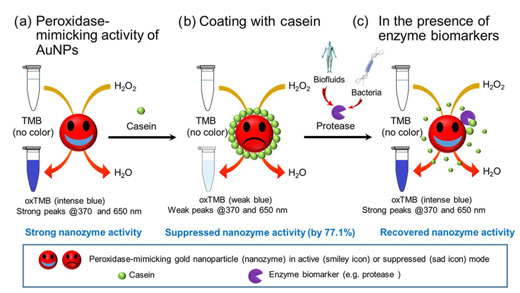
| 总体方案证明了酪蛋白包被的AuNPs的过氧化物酶模拟活性的转换用于检测酶生物标志物。(a)AuNP具有在H 2 O 2存在下催化TMB氧化的过氧化物酶模拟能力,导致oxTMB呈现蓝色并强烈吸收370和650 nm的光。(b)当酪蛋白包被在AuNP表面上时,该过氧化物酶模拟活性被抑制,导致在370和650 nm处的吸收减弱。(c)在存在衍生自生物流体或微生物的蛋白酶的情况下,表面屏蔽层(酪蛋白)的水解裂解导致AuNP的过氧化物酶模拟活性的恢复。(©Springer)(点击图片放大) | |
| 为了创建纳米传感器,研究人员首先确定在预定条件下AuNPs能够模仿天然酶的行为,即可以加速3,3‘,5‘5-四甲基联苯胺(TMB)氧化的过氧化物酶。一种蓝色产品,可以强烈吸收370 nm和650 nm的光,并且可以通过肉眼清晰看到。 | |
| 有趣的是,研究人员还发现,可以对这种行为进行调整以适合预期的应用。 | |
| 为了将此发现发展为蛋白酶检测方法,AuNP表面涂有酪蛋白(一种基本存在于牛奶中的蛋白质),其抑制酶模仿行为的能力为77.1%。 | |
| 减少的原因是酪蛋白分子阻断了表面反应,这意味着反应发生得慢得多(没有形成生动的蓝色)。 | |
| 重要的是,酪蛋白还充当蛋白酶消化的底物,由于其恢复模拟酶的行为,导致其从AuNP表面去除并随后形成鲜明的蓝色。 | |
| 研究人员还建议使用370 nm处的峰值吸光度来量化AuNPs的过氧化物酶模拟活性。这是因为在具有高电解质含量的介质中,可以诱导AuNP聚集,导致等离激元峰在650-700 nm附近发生红移。 | |
| 因此,由于纳米粒子聚集峰的潜在重叠,在该方法中650nm处的吸收峰不太有用。该发现提供了对AuNPs的过氧化物酶模拟活性的重要见解。 | |
| 使用这种方法,无需复杂或昂贵的读取设备即可在90分钟内获得结果。该方法用于牛奶和尿液分析,显示出有望作为食品安全和疾病筛查工具。 | |
|
重要的是,在AuNP表面涂上不同的分子具有将检测能力扩展到蛋白水解酶之外的潜力。 信息来源:Nanowerk |
- 上一款: 基于2D构建块的块状纳米材料路线图
- 下一款: Adv. Funct. Mater. | 基

 应用领域
应用领域
