已传文件:photo/1631586161.png
时间分辨荧光技术经历30年的发展,已经在生物医学领域的应用得到了广泛的研究。而癌症由于其高发性和高死亡率是当今医学领域研究的重中之重,时间分辨荧光技术在辅助癌症诊断、肿瘤手术边缘确定以及靶向药物递送等领域得到了研究和应用。同时NAD(P)H自发荧光、FRET技术和荧光修饰的生物传感器的高速发展,FLIM技术的应用范围也得到了进一步拓展。本文主要聚焦于FLIM技术结合自发荧光分子、FRET荧光基团对和生物传感器在癌症诊断和疗效监测应用的相关研究,并分析了当今技术发展的不足和未来在癌症领域FLIM技术的发展方向。
本文亮点
1. 综述了FLIM联合NAD(P)H、FRET和生物传感器在癌症诊断和治疗监测的应用。
3. 讨论了FLIM技术的不足及未来在癌症诊断和抗癌治疗的应用发展前景。
时间分辨荧光成像显微镜(FLIM)在过去的30年里得到了迅速的发展,并在生物医学工程中得到了广泛的应用。荧光标记探针设计的最新进展进一步拓宽了荧光的应用前景。由于荧光时间对微环境和分子层面改变更加敏感,故FLIM对疾病的诊断和疗效评估极具应用前景。
目前癌症相关的FLIM应用可分为三大类:(i) FLIM检测以NAD(P)H为代表的胞内或胞外的自发荧光分子用于细胞代谢研究;(ii) FLIM结合荧光共振能量转移用于蛋白质相互作用监测;(iii) FLIM结合荧光标记的生物传感器进行癌症异常分子检测。纳米材料和荧光时间快速计算技术的进展,以及新的癌症生物标志物的发现,促进了FLIM的优化,为癌症诊断和治疗的医学研究和临床应用提供了更多的机会。
中南大学刘艳平教授,武明花教授;澳洲悉尼大学Zongwen Liu副教授等在本文中综述了2015-2020年癌症相关FLIM应用的前沿研究,讨论了FLIM在未来癌症诊断和抗癌治疗的可能性,同时总结了当今FLIM发展的不足以及未来在癌症领域的发展方向。
荧光时间凭借其对微环境改变敏感等诸多优势在荧光成像领域得到了越来越多的应用,时间分辨荧光技术(FLIM)也随之发展。自上个世纪八十年代,第一台单分子计数-时间分辨荧光技术(TCSPC-FLIM)被发明以来,在FLIM成像速度,荧光时间测量准确性,分辨率等方面,FLIM得到了长足的发展,如双光子和多光子荧光FLIM技术不但在实验室层面得到了发展,也有越来越多的临床FLIM器械得到研制并逐步走向临床应用。而在生物医学领域,FLIM也在胞内离子浓度,蛋白相互作用,皮肤病等多个领域具有发展潜力,本文则是基于当前癌症高发生率和死亡率的现状,从NAD(P)H自发荧光,荧光共振能量转移(FRET)以及生物传感器三个方面系统论述了近五年FLIM在癌症早期诊断和疗效监测上的应用。
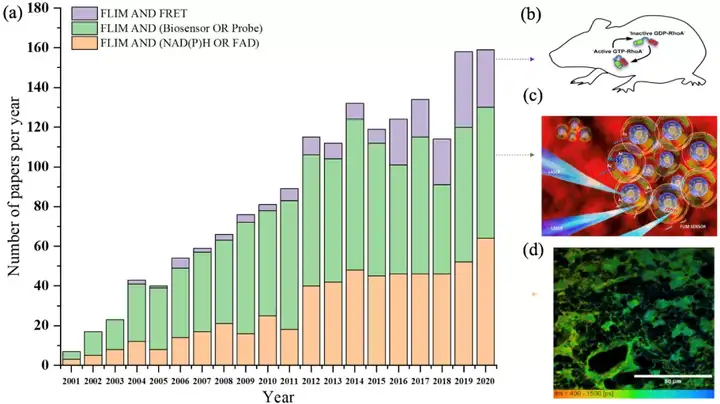
图1. 从2001年1月至2020年12月,每年在FLIM领域结合NAD(P)H或FAD(橙色),探针,生物传感器(绿色)和FRET(紫色)的出版物数量(数据来自Web of Science, 2021年1月)。(a) 2001年至2020年各领域论文数量的直方图;(b) 使用RhoA-FRET生物传感器小鼠来监测在发育和疾病进展期间哺乳动物组织中的RhoA活性。(c)
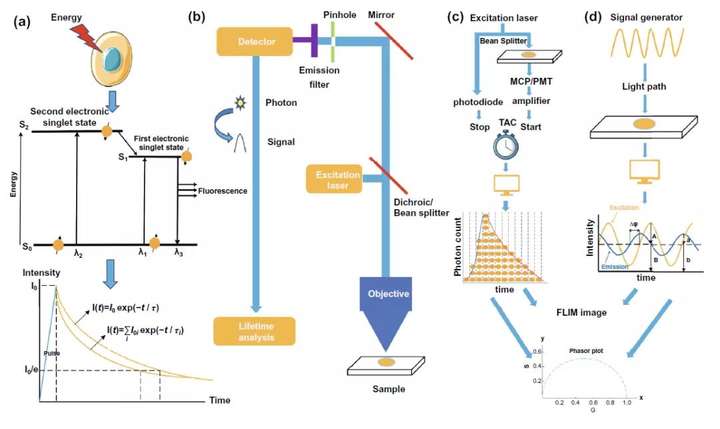
如图2a所示,当分子被激发至激发态后,它将返回到基态,而荧光正是分子从激发态回到基态的一种能量辐射形式。荧光寿命可以被简单地理解成一个物质中所有分子在激发态平均的“停留时间”,也可以经过精准的荧光强度衰减曲线记录,将荧光强度从I₀衰减到I₀/e的时间视为荧光寿命。 而在时间分辨荧光显微镜(FLIM)的构造方面,图2b介绍了FLIM是在荧光显微镜的基础框架上融合单光子检测器和光子计时装置而进行研发。基于荧光时间的测量方式,FLIM可以分为时域和频域两类,时域中又可分为TCSPC,时间门控和条纹相机三大类,其中TCSPC-FLIM的基本原理如图2c的示例图所示,通过光电倍增管的信号放大以及时幅、幅电转换将不同时刻检测到的光子依据到达时间构建荧光强度衰减曲线从而得到荧光时间。而频域FLIM的基本原理则是如图2d所示,基于对激发光的调制和检测信号的解调,利用对曲线相移等参数分析,获得荧光时间。经过仪器测得的荧光衰减曲线,依据荧光来源于单个或多个荧光分子的区别可以通过单指数或多指数函数分析计算来分析得到荧光时间。为了规避上述两种方法需要提前判断荧光分子数目和精确拟合荧光衰减曲线的缺点,相量分析在荧光时间的分析领域方面得到了越来越多的应用。利用公式将FLIM仪器所测得的参数值转换成绘制相量图(Phasor Plot)所需的g值和s值,对得到的相量图进行进一步的分析获得检测样品中荧光分子数目及各自的荧光时间等信息,并可以此为基础绘制FLIM图像。
图2. 荧光时间,荧光成像,TCSPC-FLIM和频域FLIM的基本概念。(a) 荧光时间测量的基本原理。(b) 配备有荧光时间分析装置的荧光成像仪的基本构造。(c) TCSPC-FLIM装置示意图。(d) 频域FLIM装置示意图。
III FLIM结合NAD(P)H分子的自发荧光用于癌细胞代谢监测
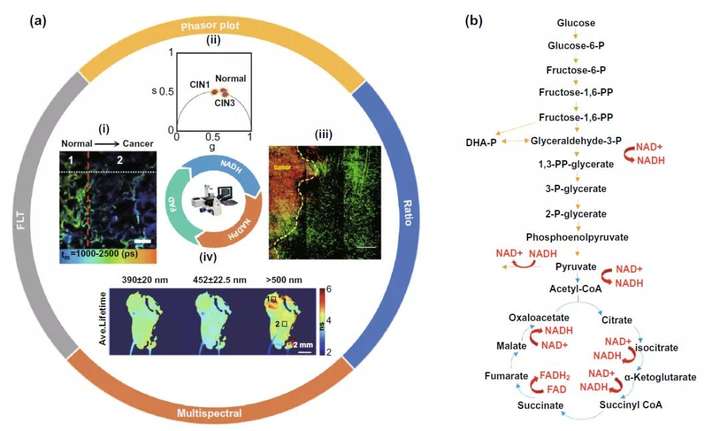
基于还原型烟酰胺腺嘌呤二核苷酸(磷酸)(NADH,NADPH)和氧化型黄嘌呤二核苷酸(FAD)的自发荧光特性,以及如图3b所示的在细胞糖酵解和三羧酸循环过程以及后续氧化磷酸化(OXPHOS)过程中NADH、FAD等分子的变化,利用FLIM检测这些自发荧光分子荧光时间的变化可以实现对癌细胞胞内代谢的监测。而在这个部分,依据直接检测参数的不同,又可以分为荧光时间、比值和相量图以及多参数FLIM三个部分。
图3. FLIM结合NADH、FAD自发荧光的研究纵览和核心糖代谢通路中NADH、FAD分子的变化情况。(a-i) 基于荧光时间差异FLIM辅助肺癌手术切除。(a-ii) FLIM相量图辅助宫颈癌癌前病变分型。(a-iii) NADH/NAD+比值辅助肿瘤边缘病灶确定。(a-iv) 多光谱FLIM辅助口腔癌前病变定位及分型。(b) 糖酵解和三羧酸循环中
在荧光时间部分,值得先说明的是,在氧化磷酸化过程中由于NADH分子会与辅酶结合而呈现蛋白质结合NADH状态,NADH分子的荧光时间将会从0.4 ns增长至2 ns。而上个世纪由Warburg提出的Warburg效应又指出癌细胞较正常组织细胞更喜欢在细胞胞质内利用糖酵解进行能量供应同时抑制通过三羧酸循环和氧化磷酸化产生ATP,故癌细胞中的荧光时间往往短于正常组织细胞,利用这一特性可以实现如图3a-i所示的肿瘤手术切除边缘的确定。但最近也有越来越多的研究发现,以肿瘤干细胞为代表的肿瘤细胞并不遵守Warburg效应,具体原因还有待探究。
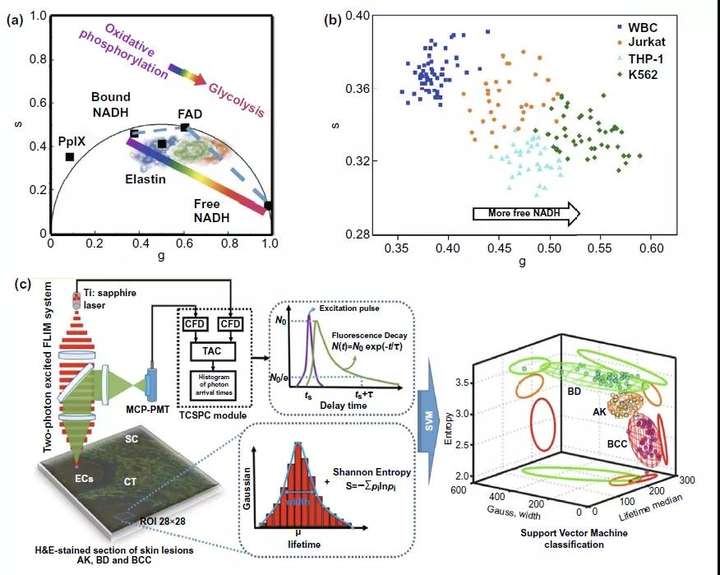
而比值和矢量图部分则是基于代谢过程中这些自发荧光分子形式的变化,利用比值放大代谢发生前后差异,达到灵敏检测的目的。如图3a-iii所示,利用糖酵解过程中增高的NADH/NAD+比值和肿瘤细胞的Warburg效应原理,可以帮助确定肿瘤手术切除边缘。而相量图则是通过多种自发荧光分子如弹性蛋白(elastin),FAD,尤其是游离型和蛋白结合型NADH在代谢过程中的改变导致的荧光时间变化(图4a),反应细胞内free-NADH/bound-NADH的比值变化,实现在宫颈癌癌前病变(图3a-ii)、白血病细胞亚型分类(图4b)等多个临床领域的应用。
在多参数FLIM领域内,多光谱FLIM(ms-FLIM)用于癌症的诊断往往集中在口腔癌前病变(图3a-iv)以及皮肤基底细胞癌等领域。同时,利用计算机对以高斯分布、信息熵以及荧光时间的分析处理,包含荧光时间的多参数分析处理模型也有望辅助临床上以基底细胞癌诊断为代表的多种皮肤疾病的诊断分型(图4c)。
图4. FLIM相量图以及多参数FLIM分类系统用于癌症领域的相关研究。(a) FLIM相量图的绘制原理,通过对相量图中自发荧光分子相量点位置等信息的分析可以获得不同检测样本中细胞氧化磷酸化、糖酵解等代谢变化信息。(b) 利用FLIM相量图中不同样本中得到的荧光分子集群式分布差异,反应不同检测样本中细胞代
IV FLIM结合荧光共振能量(FRET)技术的应用
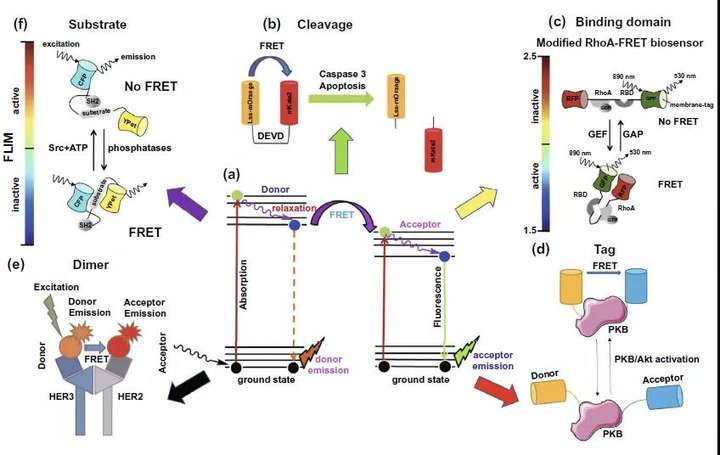
如图5a所示,荧光共振能量转移(FRET)发生在特定条件下的供体和受体荧光分子之间,利用全反射荧光显微镜(TIRF)或者时间分辨荧光显微镜(FLIM)可以实现对FRET效率或者供体荧光分子荧光时间衰减的检测。FRET-FLIM在癌症领域的检测应用依据采取的FRET荧光对的不同类型可以分为五类,荧光对裂解型(cleavage),结合域型(Binding domain),蛋白荧光分子标记型(Tag),二聚物型(Dimer)和底物分子反应型(Substrate)。荧光对裂解型主要针对产生切割效应的蛋白质的活性检测,如图5b中所示的caspase3的活性检测。Binding domain型则往往是利用靶标分子与不同底物结合时的构象差异导致的FRET发生与否的后果,实现对靶标蛋白的活性检测,如图5c中所示的RhoA蛋白。利用Tag型则是基于靶标蛋白构象改变导致相连的FRET荧光对的FRET现象变化来实现活性的间接检测,图5d针对的目标即是PKB蛋白活性检测。至于Dimer型荧光分子对结合FLIM的应用多见于在细胞膜或外泌体上会发生二聚化的受体数量或活性检测,如表皮生长因子受体家族HER2,HER3受体就是研究的代表(图5e)。最后一类底物型基本模式与Tag型很接近,两者的最大区别在于Tag型是靶标蛋白自身被激活导致的自身构象改变使得FRET效应发生变化,而底物型的靶标蛋白是通过使它的目标底物发生构象变化,而达到目标底物上相连的FRET荧光对的FRET变化,以进行活性检测(图5f)。通过对胞内或膜上蛋白质数量或者活性的改变从分子水平上达到癌症诊断或者抗癌治疗疗效评估的目的,提升癌症患者的预后。
图5. FLIM-FRET在癌症诊断和疗效提升领域内的应用。(a) FRET荧光分子对中荧光供体和受体分子间FRET现象的模式简图。(b) cleavage型:利用FRET-FLIM对caspase3的活性进行检测指示细胞凋亡状态。(c) Binding domain型:利用FRET-FLIM对RhoA蛋白的活性进行检测,通过相连的RFP和GFP荧光蛋白分子间是否发生
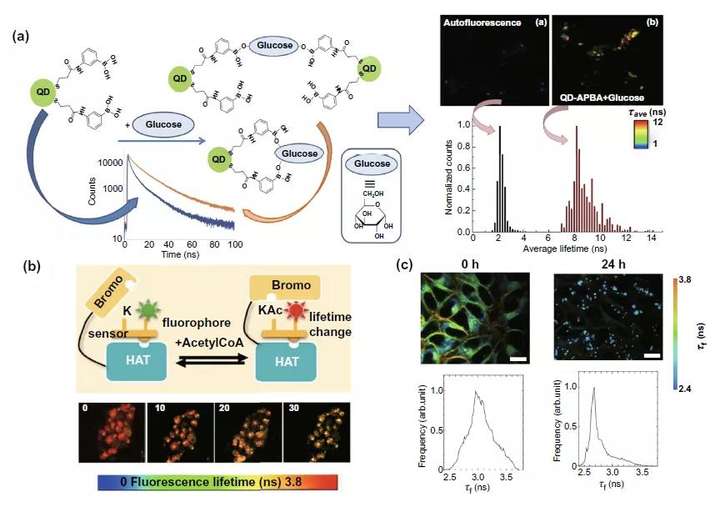
细胞内的分子变化FLIM检测可以分为核内和细胞质内两类,在细胞核内部分图6a论述的是结合一种乙酰转移酶活性生物传感器(HATS)实现对乙酰转移酶活性的检测从而辅助针对组蛋白乙酰化的抗癌药物疗效评估。在细胞质内,FLIM则可以结合新型量子点和荧光标记的香豆素探针实现对细胞质内两大代谢情况-糖代谢和脂代谢的监测,辅助癌细胞的代谢研究和临床诊治应用(图6a,c)。
图6. 荧光标记探针结合FLIM检测细胞内分子变化。(a) 左侧:QD-APBA探针检测细胞质内葡萄糖含量示意图。右侧:探针结合FLIM细胞实验结果图。(b) 使用带有荧光标记乙酰转移酶生物传感器结合FLIM从荧光时间的角度实现对细胞核内乙酰转移酶的活性检测。上图是实验机制图,下图是添加乙酰转移酶活性抑制剂后
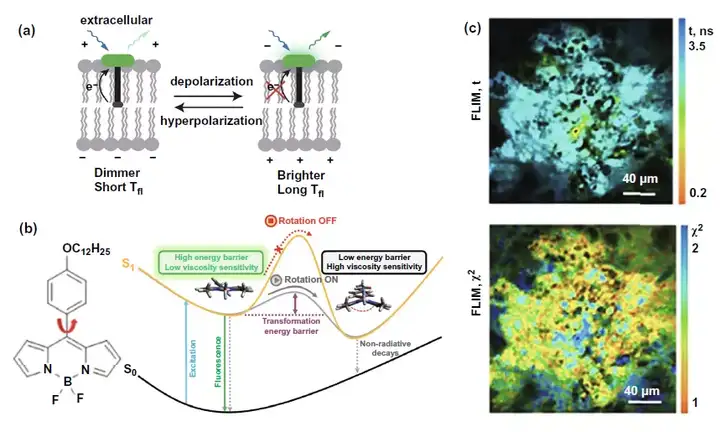
由于FLIM检测膜上受体变化情况已在FLIM-FRET部分详细论述,在这一部分主要聚焦于FLIM结合荧光探针检测细胞膜和线粒体膜的电势以及膜黏度变化的应用。这些参数与细胞膜通透性等指标相关,间接反映细胞恶性转化等细胞活动。在膜电势测量领域,图7a选择的代表性研究是利用FLIM检测VoltageFluor荧光染料标记探针的荧光时间,由于膜去极化时削弱了光诱发的电子转移,导致从超极化到去极化时检测到的荧光时间将会延长。而在膜黏度测量领域,荧光探针大多基于图7b左图所示的氯化硼络合二吡络甲川结构(BODIPY)。如图7b右图所示,当膜黏度升高时将会提升从荧光探针从平面构型转换到蝶式构型的能量壁垒,导致激发态回到基态的非辐射性途径削弱,从而使得以荧光为代表的能量辐射途径增强,荧光时间延长。图7c即是使用BODIPY2探针结合FLIM实现对体内CT26肿瘤的FLIM成像,检测细胞膜黏度。
图7. FLIM结合荧光探针检测膜电势和黏度用于癌症诊断和疗效监测。(a) VoltageFlour探针结合FLIM测量膜电势的机制图。(b) 左图:BODIPY结构代表分子式;右图:使用BODIPY探针检测膜黏度变化的机制图。(c) 上图:FLIM结合BODIPY2探针得到的动物体内CT26肿瘤FLIM图像,将之用于膜黏度评估;下图:时间分辨
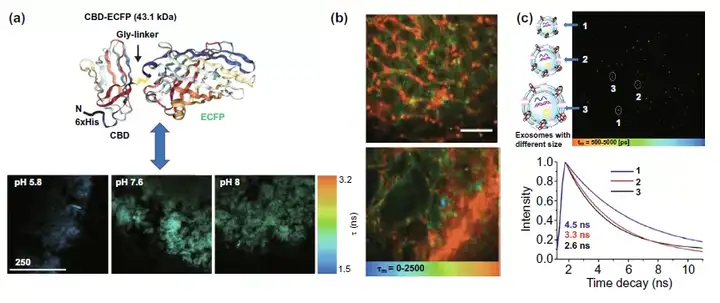
在肿瘤细胞外环境中,主要讨论了结合荧光探针、量子点等荧光材料是否有望实现对肿瘤微环境的pH,血管构成以及外泌体进行检测。使用融合有ECFP荧光蛋白的CBD-ECFP分子可以实现利用荧光时间反映体外基质中pH的目的(图8a)。而肿瘤血管成像则是基于血液中循环的量子点的长时荧光特性,探究肿瘤组织和正常组织血管形态差异(图8b)。而图8c则是利用膜黏度探针的荧光时间反映外泌体的膜黏度从而得到外泌体大小的信息,有望用于临床癌症早期诊断。
图8. FLIM细胞外环境应用。(a) FLIM检测CBD-ECFP荧光时间反映体外基质pH。(b) 利用量子点长时荧光实现肿瘤微环境内血管成像。(c) 应用Mem-BDP膜黏度探针的荧光时间实现对细胞外泌体的大小检测。
图9a是利用FLIM探究带有OG荧光标记的外泌体和微囊泡紫杉醇递药方式入胞机制,研究发现外泌体主要通过胞吞方式入胞,而微囊泡则通过胞吞和与细胞膜融合两种方式入胞。而在脂质体递药策略(liposome)研究中,图9b的研究中使用FLIM探究了体内递送过程中生物分子冠状物在脂质体周围形成导致载药泄露的问题。除了前面两类抗癌药物递送策略,近年来以纳米结构为基础的抗癌药物递送新策略不断涌现,一种如图9c所示的PAH-Cit-Dox的纳米递送策略得到了构建和实验室研究,使用FLIM得到FLIM相量图(Phasor plot)和相量区分的荧光时间像素图(PDLPI)对阿霉素的释放和其在细胞内的分布进行了监测,辅助递送策略优化和疗效提升。
图9. FLIM监测具有荧光发射特性的抗癌药物递送辅助疗效提升。(a) 应用FLIM探究载有紫杉醇-OG的外泌体和微囊泡的入胞机制。(b) 应用FLIM研究脂质体递药策略生物分子冠状物形成(BC)导致的载药泄露的问题。(c) 一种全新的纳米阿霉素(Dox)药物递送系统PAH-Cit-Dox的机制图。(d) 利用FLIM检测得到的PDLPI图
1. FLIM成像速度,分辨率提升以及与其它光学技术的整合成像。
2. FLIM走向临床应用在荧光分子生物相容性、靶向性,以及深层次穿透能力如近红外荧光分子研究仍需进行。
3. FLIM结合NAD(P)H自发荧光用于代谢检测可以拓宽至肿瘤微环境中的免疫细胞、神经元等,辅助肿瘤免疫治疗等研究。
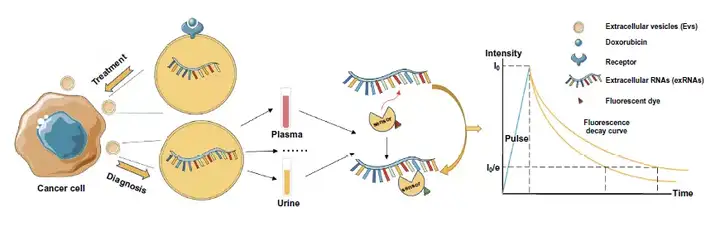
4. 利用荧光探针结合FLIM有望实现肿瘤外泌体中RNA检测,而以阿霉素(Dox)为代表的抗癌药物递送也可与外泌体策略结合,使用FLIM监测优化。
图10. 外泌体-FLIM应用于外泌体RNA检测和抗癌药物递送的设计思路。
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除