
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

微凝胶正逐步进入组织再生领域,因为它们克服了传统的大块/宏观水凝胶存在的问题,如细胞间接触和细胞间通讯有限以及扩散率低。由于通过微创手术可增强质转移和注射能力,这些微凝胶正成为一种有前途的骨再生应用方法。然而,凝胶基质组成如何影响细胞反应和整体组织形成在从整体结构转换为微凝胶结构的理解上仍有很大的差距,针对这个问题,来自澳大利亚莫纳什大学的Jessica E. Frith教授团队在Biomacromolecules上发表了题为“Interplay of Hydrogel Composition and Geometry on Human Mesenchymal Stem Cell Osteogenesis”的研究性论文。作者制备了单独或同时含有明胶和透明质酸(HA)的聚乙二醇基微凝胶,并评估了水凝胶的组成对封装的人骨髓间充质干细胞(hBMSCs)成骨分化的影响(图1)。

图1(A)巯基-降冰片烯点击反应示意图;(B)块状水凝胶和微凝胶制备示意图
首先,作者设计了三种不同的含有硫醇功能化PEG (PEG-(SH)2)的水凝胶,并与降冰片功能化明胶(Gel-NB)或降冰片功能化透明质酸(HA-NB)或Gel-NB和HA-NB的混合凝胶混合使用。水凝胶的光交联动力学通过原位光流变学进行监测,结果显示,无论水凝胶组成如何,光暴露的几秒钟内就能迅速形成凝胶。从压缩测试中得到的应力-应变曲线可知,Gel、Gel:HA和HA水凝胶的压缩模量分别为5.2、3.3和2.3 kPa,与存储模量的变化趋势相同。这些数据表明,水凝胶的硬度呈现出Gel>Gel:HA> HA的趋势。由于高含水量的水凝胶往往比含水量少的水凝胶更软,HA和明胶亲水性的差异也可能导致由它们形成的水凝胶的力学性能的差异(图2)。

图2 Gel、Gel:HA和HA块状水凝胶的表征
接下来,作者使用基于移液管的微流体技术合成Gel、Gel:HA和HA微凝胶。对微凝胶的大小和分布进行了表征。Gel:HA微凝胶与在块状水凝胶中观察到的溶胀一致,都归因于HA的高亲水性(图3)。
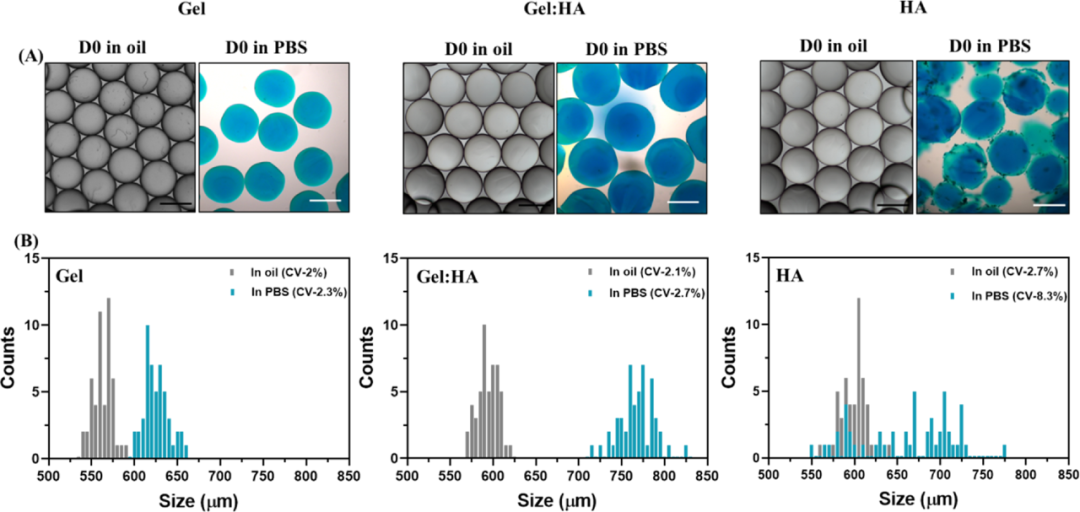
图3 Gel、Gel:HA、HA微凝胶的表征
为了了解水凝胶对细胞培养的稳定性和适宜性,作者测定了三种水凝胶制剂在大体积和微凝胶状态下的体外降解率。与块状水凝胶相比,在DPBS中Gel:HA和HA水凝胶的质量显著增加。所有体积水凝胶的凝胶质量在10天内保持相对稳定。10天后,观察到所有水凝胶成分的质量逐渐增加,HA 增加的比例更高。同时微凝胶的降解性能与整体水凝胶有显著差异。微凝胶与块状水凝胶的比表面积的增加增加了传质导致块状水凝胶更快的降解,这种效应对于高亲水性的HA微凝胶更为明显,可能是由于较高的溶胀程度(图4)。

图4(A)巯基-降冰片烯点击反应示意图;(B)块状水凝胶和微凝胶制备示意图
为了评估水凝胶组成和几何结构在生物学功能上的相互作用,作者评估了不同水凝胶组成在块状和微凝胶形态下支持hBMSC培养的能力。将hBMSCs以块状和微凝胶的形式封装,在基础培养基中培养1天和7天后,通过活/死染色评估细胞存活率。包封后24小时和培养7天,三种成分的块状水凝胶和微凝胶的细胞存活率均超过85%。HA水凝胶可以归因于在透明质酸单独水凝胶中缺乏细胞黏附和扩散,这是锚定依赖细胞如间充质干细胞生存和生长所必需的。这些图像也提供了细胞分布的初步指示,其中间充质干细胞呈圆形分布在第1天上的微凝胶中,但迁移到微凝胶的外围并在第7天前扩散,从而使荧光更加强烈(图5)。

图5 块状水凝胶和微凝胶封装的hBMSCs的细胞存活率评估
之后,进一步对hBMSC的扩散和细胞骨架形态进行分析。结果显示,Gel和Gel:HA水凝胶中的细胞分布良好,突出明显,表明与聚合物基质有良好的相互作用和粘附。相反,HA水凝胶中的细胞保持圆形,可能是由于HA中缺少结合位点。无论组成如何,对于块状水凝胶而言,囊化细胞的分布是均匀的。相比之下,Gel和Gel:HA微凝胶中几乎所有的囊化细胞都迁移到微凝胶外周,但这种影响不明显。作者推测,这可能是由于细胞主动感知到微凝胶表面更高的传质和营养浓度,从而迁移到表面(图6)。
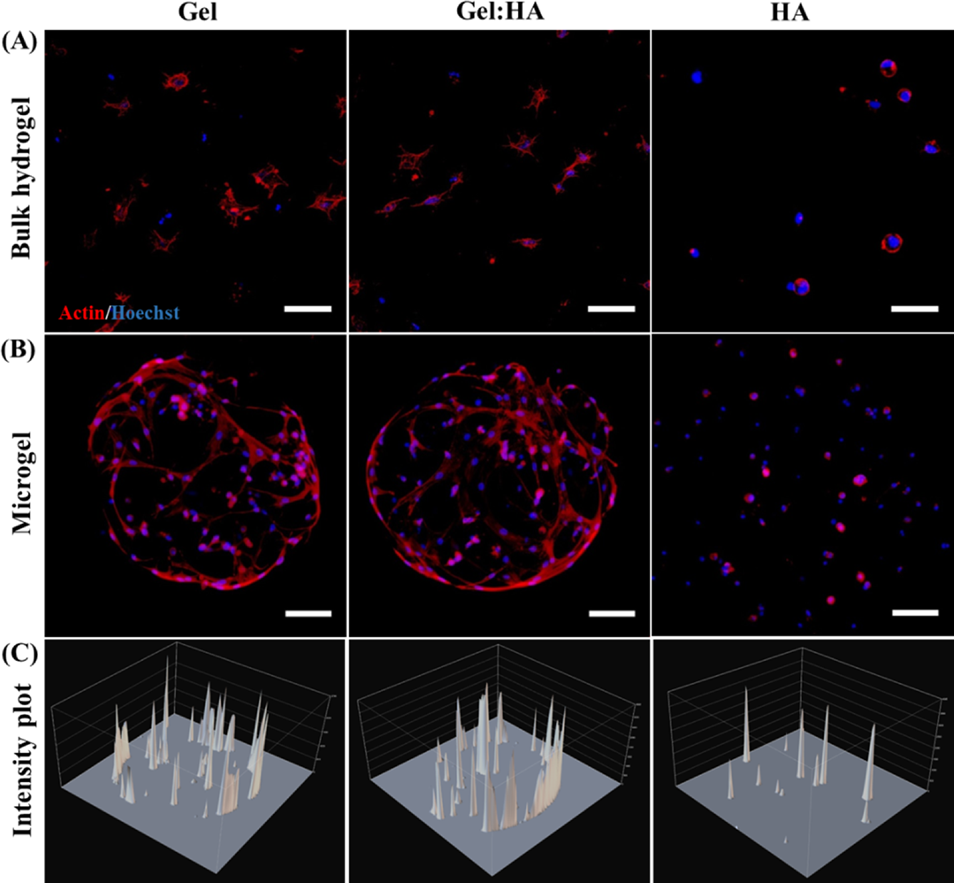
图6 细胞在块状水凝胶和微凝胶中的形态
为了确定水凝胶组成和几何形状对间充质干细胞分化的影响,所有组成的体积水凝胶和微凝胶均在基础培养基和骨诱导培养基中培养7天。与基础培养相比,骨诱导培养中ALP和RUNX2基因表达明显上调,表明hBMSC成功分化为成骨细胞系。此外,Gel和Gel:HA内的hBMSC成骨诱导培养中ALP和RUNX2的表达明显高于2D单层细胞培养。这强调了3D平台相对于2D平台的优势。相反,HA水凝胶不支持成骨。同样的,与块状凝胶相比在微凝胶中ALP表达也明显增高(图7)。
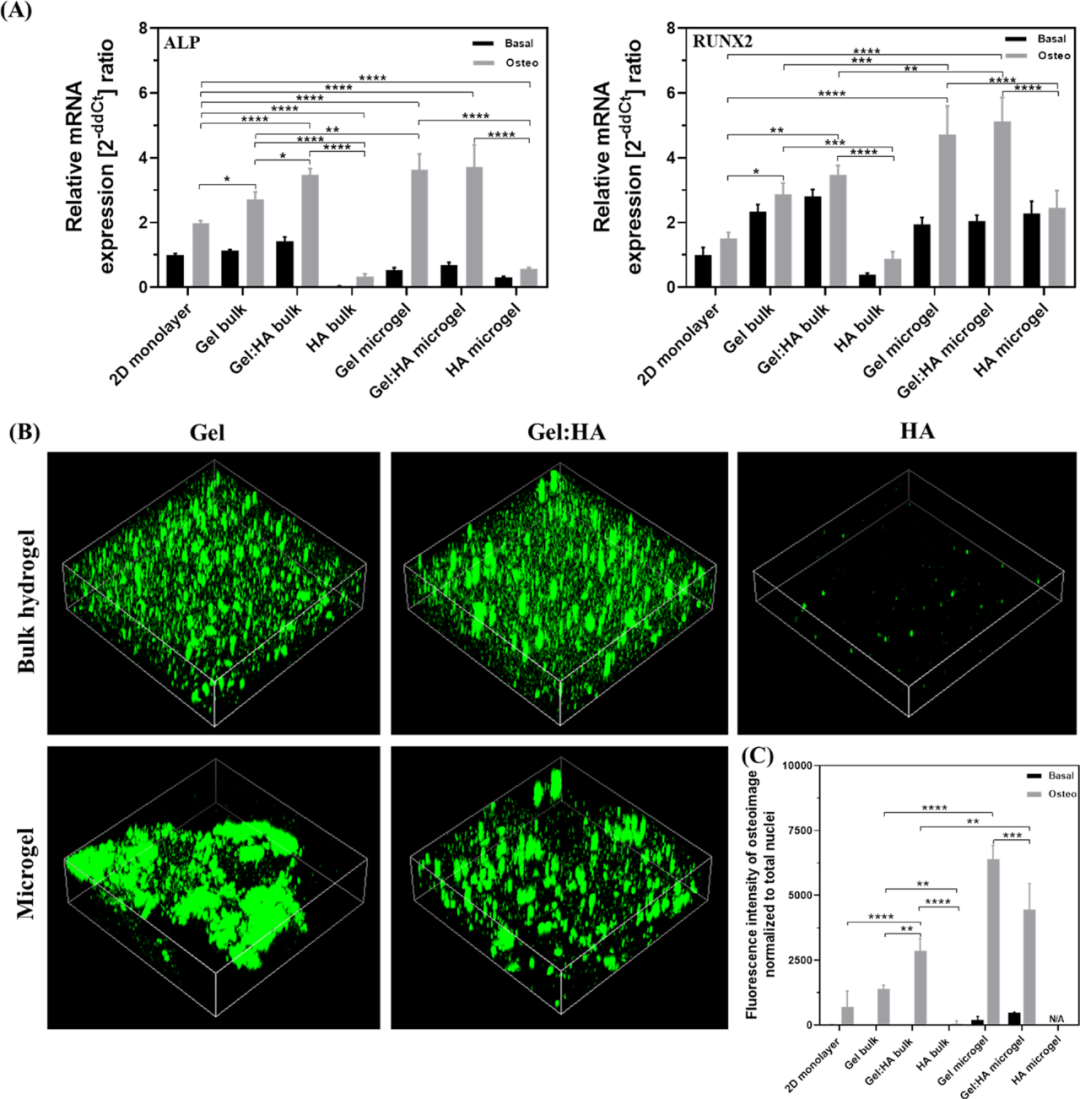
图7 在2D、块状水凝胶以及微凝胶中对hBMSCs进行成骨分化检测成骨分化标志物
最后,作者为了验证不同的羟基磷灰石对Gel和HA的亲和力是导致矿化差异的原因这一假设,分别检测了羟基磷灰石(HAP)的成核和保留是否受到不同水凝胶组成的影响。通过将羟基磷灰石纳米粒子(200 nM)与无细胞微凝胶孵育24小时,然后洗涤多余的羟基磷灰石纳米粒子,测试了羟基磷灰石对研究中使用的每种水凝胶的亲和力。明场图像清楚地显示了微凝胶表面羟基磷灰石沉积的组分差异,其中凝胶微Gel沉积最多,其次是Gel:HA和HA微凝胶。羟基磷灰石与微凝胶表面结合,通过骨图像染色和强度定量进一步说明,Gel显示出比Gel:HA和HA更强的荧光。明胶作为胶原的来源,可能有利于为磷灰石晶体的形成提供成核点,而对几种糖胺聚糖的研究表明,HA对羟基磷灰石的亲和力最弱(图8)。
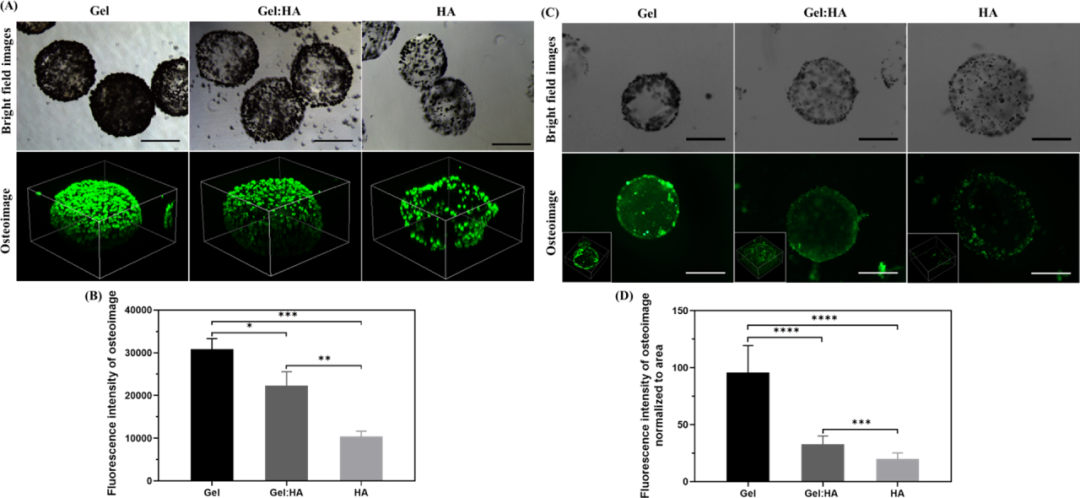
图8 羟基磷灰石亲和和成核研究分析 在本研究中,作者通过系统地研究水凝胶组成和几何结构这两种因素对hBMSC包封和成骨的影响,为水凝胶组成和几何结构之间的相互作用提供了新的见解。作者的研究结果表明,骨髓间充质干细胞的成骨分化在很大程度上受到水凝胶组成和几何形状的影响。与仅含HA的水凝胶相比,含Gel的水凝胶显示出良好的细胞扩散和成骨作用。对于块状水凝胶,羟基磷灰石与明胶的结合增强了成骨分化,但尽管微凝胶的表现通常优于整体水凝胶,但在微凝胶中,羟基磷灰石的这种作用是相反的。作者对水凝胶组成和结构的研究,为以组织工程目的设计水凝胶,提供了新型的复合材料的新思路。
信息来源: EngineeringForLife
本信息源自互联网仅供学术交流 如有侵权请联系我们立即删除
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫