
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

糖尿病(DM)是一种普遍存在的慢性疾病,其特征在于持续的高血糖水平。在糖尿病患者中,预计约19–34%会发展为糖尿病慢性伤口,这是常见,复杂且代价高昂的并发症。据预测,几种内在的致病性异常(神经病,血管问题以及由于糖尿病引起的其他复杂的全身影响)和外在因素(伤口感染,愈伤组织形成以及对该部位的压力过大)都可能导致愈合失败。尽管尚不能很好地理解皮肤糖尿病性伤口愈合不良的确切机制,但公认的主要病因是氧化应激,血管生成受损,促炎细胞因子表达增加和细菌感染引起的伤口微环境中的慢性炎症。长期持续伤口的原因。表没食子儿茶素-3-没食子酸酯(EGCG)是绿茶中最丰富的多酚化合物,近年来引起了相当大的关注。由于EGCG具有多种药理特性,包括杀菌,抗炎,抗氧化,抗衰老,促血管生成和抗癌作用,因此EGCG已在不同领域得到广泛评估。然而,EGCG具有一些缺点,这些缺点限制了它们的应用前景,包括不良的生物利用度和快速的代谢。因此,对于糖尿病伤口的治疗,非常需要开发合适的药物递送系统(DDS),其可以将EGCG有效且精确地递送至伤口部位并以受控方式释放多酚。由于缺乏能够将匹配的机械强度,快速的自愈性,便捷的敷料更换以及多种治疗效果整合到一个系统中的理想的伤口敷料,目前对慢性糖尿病伤口的治疗仍然不能令人满意。最近,西安交通大学李昂/成一龙教授和中科院长春应用化学所陈学思院士团队在《Advanced Functional Materials》上发表了Green Tea Derivative Driven Smart Hydrogels with Desired Functions for Chronic Diabetic Wound Treatment一文。得益于儿茶酚基团和表没食子儿茶素-3-没食子酸酯(EGCG,绿茶衍生物)的治疗作用,研究人员通过将EGCG和3-丙烯酰胺基苯硼酸(APBA)形成的复合物共聚,方便地获得智能水凝胶敷料)(形成硼酸酯键)和丙烯酰胺。所得的水凝胶具有强机械性能,自修复能力和组织粘附性。大量释放的EGCG不仅可以实现抗氧化,抗菌,抗炎和促血管生成作用,还可以调节巨噬细胞极化来加速伤口愈合,还可以方便换药。这种先进的水凝胶为糖尿病慢性伤口的处理提供了一种简便而有效的方法,并且可以扩展用于治疗其他复杂的伤口愈合。

为了满足慢性糖尿病伤口的水凝胶伤口敷料的所有所需特性,作者设计了多功能“智能”水凝胶,利用EGCG和APBA之间的预组装复合物(E-A复合物)作为动态交联剂与丙烯酰胺共聚(AM)(图1a)。由于硼酸酯键的动态性质,水凝胶具有适度的组织粘附能力,易于使用,并且可以很容易地从皮肤组织上剥离而没有任何残留物(图1b);两次接触的水凝胶物质仅接触3分钟即可有效自修复,承受3倍伸长(图1c);这些出色的性能可以确保伤口部位的有效密封,并防止在正常的身体动作和局部压力下失去保护。此外,EGCG可以以可控的方式原位释放,发挥抗微生物,抗氧化,促血管生成和抗炎作用,并在临床所需的时间范围内加快愈合过程(图1d)。重要的是,随着EGCG的释放,水凝胶网络逐渐解离,可以通过用伤口清洁剂擦拭或淋洗伤口部位来换药,从而完全去除水凝胶网络,从而可以防止新形成的组织受损并改善护理质量。报道的刺激触发的可溶性水凝胶敷料。
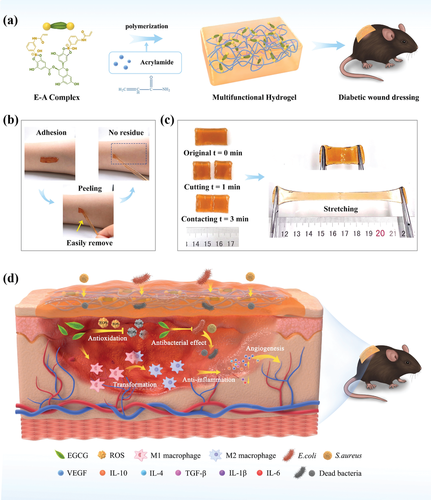
图1 a)EACPA水凝胶敷料的制备程序示意图。b)水凝胶粘附在作者的皮肤上。剥离后,未发现残留物。可以观察到足够的粘合性。c)图片显示自我修复的EACPA水凝胶承受外力大拉伸的能力。d)在糖尿病C57BL/6小鼠模型中,说明了EACPA水凝胶促进全层伤口慢性伤口愈合的机制如图2a所示,制备的E-A配合物和AM水溶液(2 m)的混合物在室温下呈溶胶状态,并在用氮气吹扫5分钟后加入APS和TEMED时经历了溶胶-凝胶转变。扫描电镜(SEM)结果表明,所有EACPA水凝胶样品均呈现出不规则且多孔的网络结构,其孔径为数百微米(图2b)。较高的E-A络合物浓度导致降解速率较慢,这是由于增强的交联密度(图2c)。使用动态交联剂形成的水凝胶通常表现出有希望的机械性能,例如良好的可回收性和优异的柔韧性。如图2d所示,EACPA水凝胶的球形可以立即恢复到初始状态,压缩后不会受到任何损坏。此外,EACPA水凝胶的棒状形状可承受不同的变形,例如扭曲和弯曲,从而显示出出色的柔韧性。如图2e所示,进一步进行了三种水凝胶的拉伸试验。作者发现系统中E‐A复合物的增加导致拉伸应力和断裂伸长率提高。具有最高E‐A复合物含量(9 mm)的水凝胶表现出最高的拉伸强度(29.0±6.6 kPa)和最高的断裂伸长率(661.6±43.4%)。详细结果总结在图2f中。

图2 EACPA水凝胶的形态,降解曲线和力学特性基于硼酸酯键的材料在野外条件下会不断发生反应物(硼酸衍生物和儿茶酚)与产物(硼酸酯)之间的动态交换,因此材料通常具有出色的自愈性能。如图3a所示,当分离的水凝胶表面接触时,硼酸酯键的重排可立即促进水凝胶的愈合。对于实际应用,敷料在正常的身体运动和局部应力作用下断裂后的快速自修复可以防止外部感染并为伤口愈合保持无菌环境。如图3b所示,将粘在作者手指上的水凝胶片切成两部分,以模仿敷料的破裂。在两个部分接触30 s后,已修复的水凝胶可以承受手指的来回弯曲,显示出出色的实用性。然后进行流变学研究,以评估EACPA水凝胶的自愈行为(图3c)。
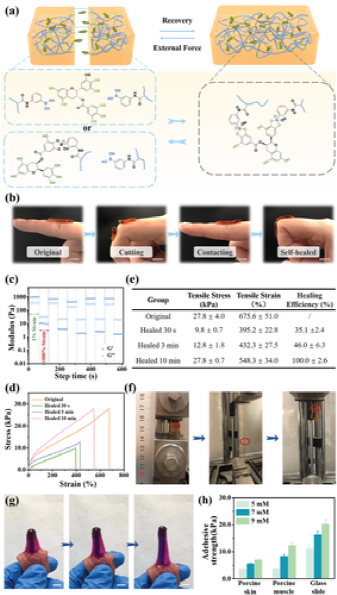
图3 EACPA水凝胶的自修复和组织粘附特性。a)EACPA水凝胶的自愈过程示意图。b)宏观观察粘附在手指上的EACPA水凝胶的自愈作用。c)在1%和1000%应变之间的五个循环中,使用9 mm E‐A复合物的EACPA水凝胶敷料的G和G。d)在室温下分别愈合30 s,3分钟和10分钟后,水凝胶的拉伸应力-应变曲线。e)EACPA水凝胶在室温下分别恢复30 s,3分钟和10分钟后的自我修复效率摘要(n = 5)。f)EACPA水凝胶的拉伸试验照片在室温下愈合10分钟(红色圆圈是水凝胶的切割部位。g)对新鲜无骨猪肉片的粘附性和EACPA水凝胶的可扩展性图像。h)EACPA水凝胶对猪皮肤组织,猪肌肉组织和载玻片的粘附强度EACPA水凝胶的细胞生物相容性通过(3-(4,5-二甲基-2-噻唑基)-2-5,5-二苯基溴化四唑(MTT)测定和活/死染色进行评估。不同质量的EACPA水凝胶与细胞培养基在37°C下温育24 h,浸出后用于细胞培养(L929细胞),首先进行MTT分析以测试水凝胶处理的细胞的代谢活性。如图4a所示,当水凝胶浓度达到10 mg mL-1时,孵育24小时后细胞活力高于95%,实验组和对照组之间没有明显差异。用活/死染色法观察细胞的生物相容性,活细胞和死细胞分别用绿色和红色荧光染色,发现大多数L929细胞呈现正常形态,经10次处理的细胞mg mL-1 EACPA水凝胶表现出相似的作为对照组的增殖趋势(仅组织培养板)(图4b)。

图4 细胞相容性,抗氧化效率,细菌生长抑制作用以及EACPA水凝胶将巨噬细胞表型从M1转变为M2结果发现,DPPH清除效率表现出EACPA水凝胶浓度依赖性,样品水凝胶具有明显的抗氧化性,清除自由基的效率为80%,而水凝胶浓度大于3 mg mL-1(图4c)。如图4d所示,在用10 mg mL-1水凝胶处理的L929细胞中观察到明显的荧光猝灭,并且荧光强度与对照组相似,与Rosup介导的阳性组相当。以上结果证明,EACPA水凝胶具有所有理想的特性,可作为糖尿病慢性伤口的强大伤口敷料。因此,作者评估了全厚度糖尿病伤口模型上EACPA水凝胶的治疗效果。连续5天通过腹膜内注射链脲佐菌素(STZ)在C57BL/6小鼠上建立了糖尿病小鼠模型,因为STZ诱导的糖尿病动物模型已被广泛用于研究糖尿病受损的伤口愈合。血糖在4周内基本上超过300 mg dL-1(16.65 mmol L-1)的小鼠用于治疗EACPA水凝胶敷料。接种直径为8 mm的全厚度背侧皮肤穿孔创口,然后分别用Tegaderm膜,EACPA水凝胶敷料或不穿衣服(对照组)进行治疗。治疗的细节总结在图5a中。在图5b中示出了在预定时间间隔的不同组中的伤口的代表性图片。宏观上,作者发现EACPA水凝胶的愈合效率比未治疗组高得多,观察18天后,未治疗小鼠仍观察到干sc。此外,根据伤口照片测量了实验时间范围内的定量伤口面积(图5c)。
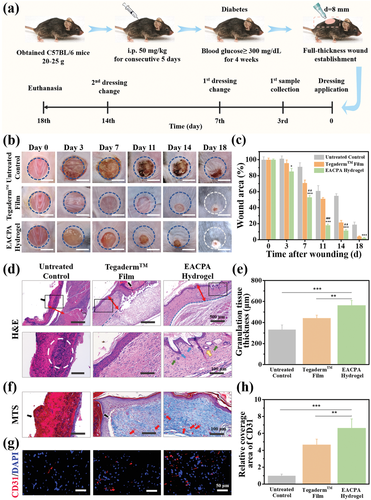
图5 EACPA水凝胶对糖尿病慢性伤口的治疗效果为了从组织学角度评估EACPA水凝胶敷料的愈合效果,在第18天收集的再生皮肤组织上进行了苏木精和曙红(H&E)和Masson三色染色(MTS)染色。组织学结果与伤口残留一致在数字图像中观察到的区域。在未经治疗的对照组中可以观察到包囊结of中包死的大量炎性细胞,这表明炎症发生在愈合的早期(图5d,白色虚线圆圈)。EACPA水凝胶和商业敷料组均维持了减轻的炎症环境,有利于伤口愈合。EACPA水凝胶组在创面床处形成的肉芽组织在第18天也得到了显着增强,与商业薄膜敷料组相比,厚约120 μm(图5e)。此外,EACPA水凝胶组收集的组织也显示出比对照组和Tegaderm膜组更好的组织结构,其中EACPA水凝胶组可以清楚地观察到毛囊,皮脂腺,汗腺导管和鳞状上皮(图5d )。此外,进行MTS来检测新生胶原蛋白在伤口愈合区域的沉积(图5f)。众所周知,炎症微环境在伤口愈合和组织再生过程中至关重要。慢性伤口的炎症阶段被严重延长,甚至无法过渡到增殖阶段。因此,巨噬细胞主要表现为促炎性M1表型,并产生一系列炎症细胞因子(即IL-1β)。和白介素-6(IL-6)诱导组织破坏和器官功能障碍;M2表型巨噬细胞的数量,它们分泌高水平的抗炎细胞因子和修复性生长因子(例如,血管内皮生长因子(VEGF),表皮生长因子(EGF))以减少炎症,调节肉芽形成并促进组织再生,大大减少了。由于这些细胞因子和生长因子高度参与伤口愈合过程的不同阶段,为进一步探索EACPA水凝胶敷料减轻炎症反应和促进组织愈合的机制,在不同治疗后三天收集伤口周围的组织(图6a)和伤口组织中趋化因子的含量首先通过ELISA分析检测(图6b)。
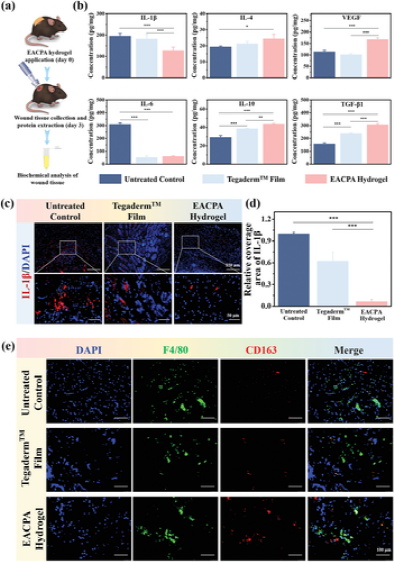
图6 EACPA水凝胶调节炎症微环境,以促进慢性糖尿病伤口的愈合。a)在进行以下测试的不同处理后的第3天收获伤口组织。b)通过ELISA测定与伤口组织中的炎症和血管生成有关的趋化因子的浓度。c)第3天,皮肤伤口组织中IL-1β(红色)和细胞核(蓝色)的免疫荧光图像。d)IL-1β相对覆盖面积的定量分析。e)处理后用F4/80(红色)和CD163(绿色)染色的伤口组织中巨噬细胞的免疫荧光图像论文链接:doi.org/10.1002/adfm.202009442
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫