
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

软骨植入物结构稳定性差和内源性激活不足,可能是微骨折后软骨再生的关键因素。本书中,受胶原纤维对蛋白聚糖限制作用的启发,我们通过静电相互作用和共价共轭,连续共组装生物活性多糖、蛋白质和肽,开发人工蛋白聚糖组装(DSPG@Pep)。该 DSPG@Pep 具有抗肿胀、抗压和抗降解特性,显著激活内源性干细胞招募和直接软骨分化。具体来说,DSPG@Pep 下调钙信号通路(如 CACNA1G、AVPR1A 等)和 ECM 受体相互作用(IBSP 和 COL4A2),从而减少骨化倾向(EFEMP1、SCUBE3 和 SPARCL1),这表现为细胞质钙浓度降低和整合蛋白β1 聚集。雄兔和猪的软骨缺损模型证实 DSPG@Pep 可以稳定固定在缺损部位,促进新软骨的结构和功能重塑。这些发现为内源性软骨再生提供了有前景的生物材料设计策略。

微骨折手术是临床修复关节软骨缺损的常用方法,但其诱导再生的多为纤维软骨,机械性能差且易退化。植入材料本身的结构稳定性不足与内源性活化能力有限,可能是影响术后软骨有效再生的关键因素。天然软骨中,胶原纤维网络与蛋白聚糖聚集体协同作用,不仅赋予组织良好的力学与润滑性能,更重要的是胶原纤维能够限制蛋白聚糖因吸水而过度膨胀,从而维持基质的结构稳定。然而,这一天然稳定机制在以往的人工软骨仿生材料设计中并未得到充分借鉴与应用。
受此启发,研究团队通过分子水平的逐级共组装策略,成功构建了一种抗溶胀且具备自活化功能的人工蛋白聚糖组装体。该材料以多酚修饰的丝素蛋白和巯基化透明质酸为基本组装单元,首先通过静电作用形成前驱体,再在pH调控下发生化学交联,形成具有纤维束状结构的稳定网络。进一步地,通过连接活性多肽,赋予材料主动招募内源性干细胞并引导其向软骨分化的生物学功能。实验表明,这种人工蛋白聚糖组装体具有优异的抗溶胀、抗压缩和抗降解性能,其力学性能显著优于未引入仿生稳定机制的对照组材料。
体外细胞实验与转录组学分析揭示了材料促进软骨再生的深层机制。这种人工蛋白聚糖组装体能有效招募骨髓间充质干细胞,并通过下调钙信号通路和细胞外基质-受体相互作用等相关基因的表达,降低胞质钙离子浓度,减少整合素β1的簇集,从而抑制了软骨内骨化的倾向。这为干细胞营造了一个更有利于向软骨方向分化而非成骨分化的微环境,促进了糖胺聚糖和II型胶原的分泌,同时减少了I型和X型胶原的产生,有助于形成透明软骨样组织。
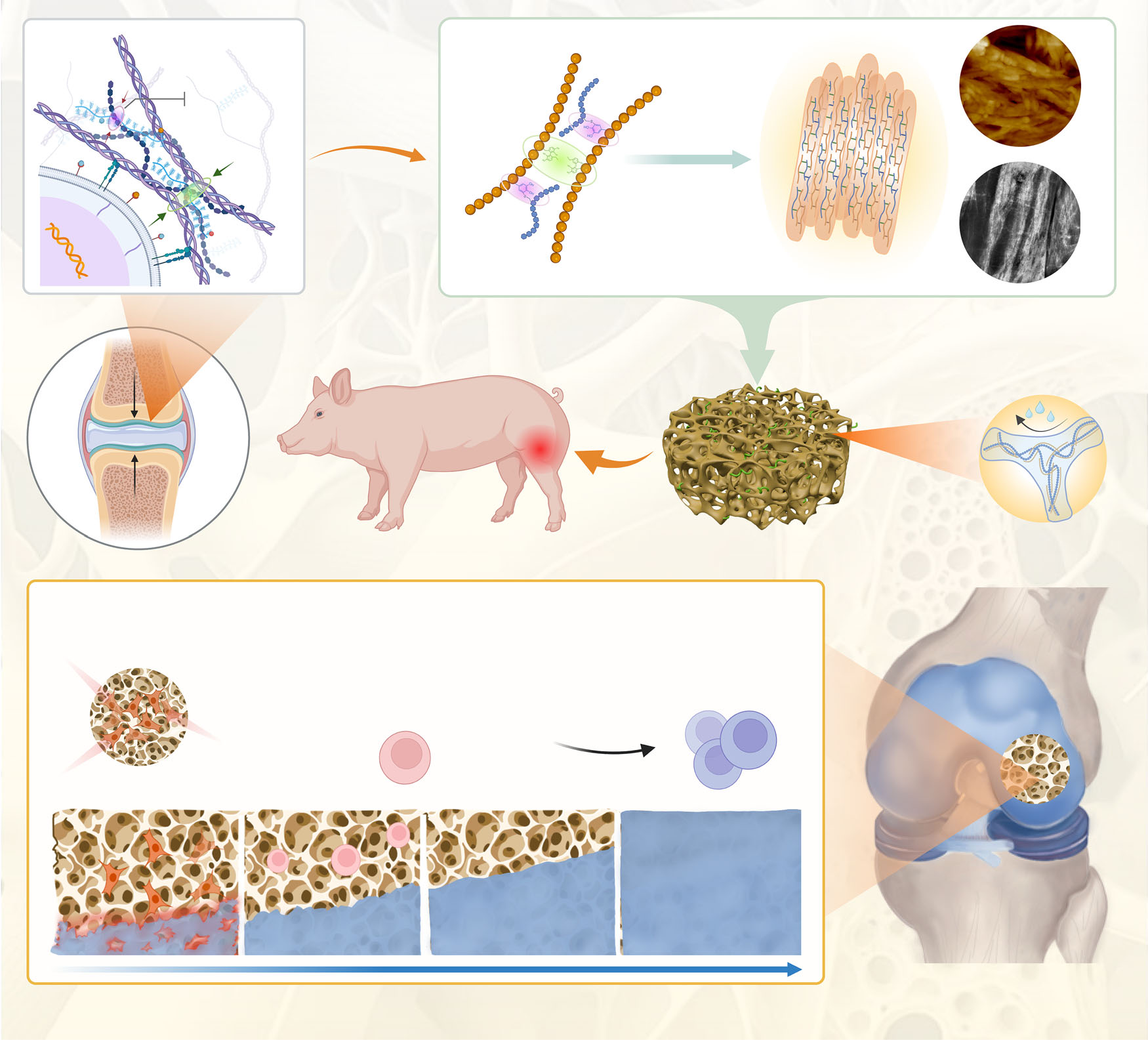
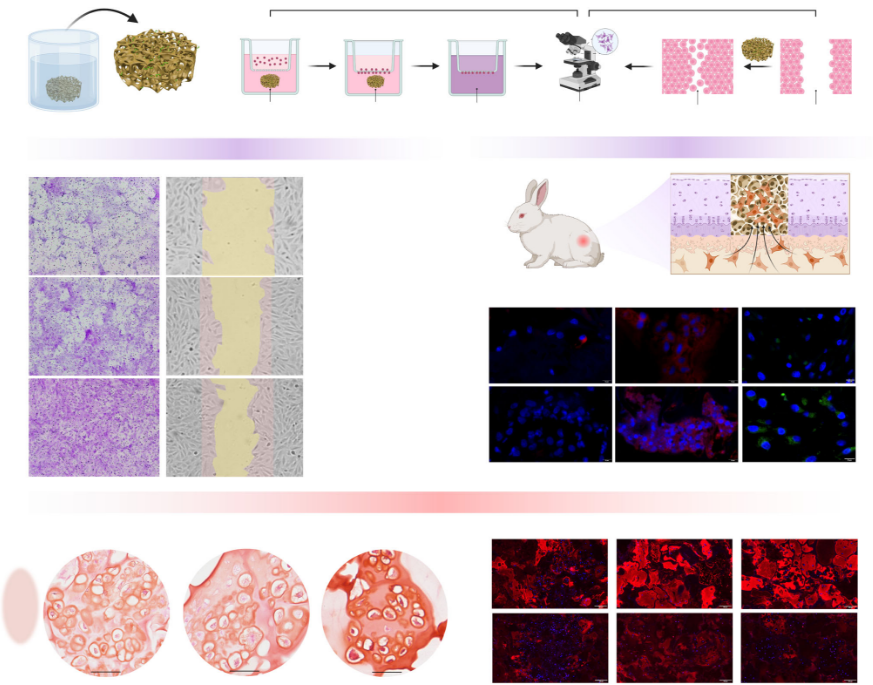
研究在兔和巴马猪的关节软骨全层缺损模型中验证了该材料的修复效果。植入后,材料能够稳定固定在缺损部位,有效抵抗骨髓血浸润后的肿胀与降解。长期观察显示,实验组缺损被新生软骨完全覆盖,新生软骨与周围天然软骨整合良好,且软骨下骨结构完整。组织学染色、影像学评估及生物力学测试均证实,新生软骨在组织形态、胶原排列、特异性基质分泌及力学性能方面均接近天然透明软骨,显著优于单纯的微骨折手术对照组。
这项研究通过仿生天然软骨中胶原纤维限制蛋白聚糖的结构稳定机制,并结合活性多肽赋予材料生物学功能,成功开发出一种结构稳定、能主动激活内源性修复过程的人工软骨植入物。它不仅解决了传统仿生材料在体内易溶胀降解、稳定性差的问题,还避免了引入外源性细胞或生长因子带来的复杂性与风险,为临床微骨折术后实现高质量的软骨再生提供了一种具有潜力的新材料设计策略。
参考消息:
DOI: 10.1038/s41467-025-67035-6
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫