Advanced Materials | 液态金属纳米颗粒介导的线粒体损伤增强了癌症疫苗治疗中的免疫细胞死亡
QQ学术交流群:1092348845
详细介绍
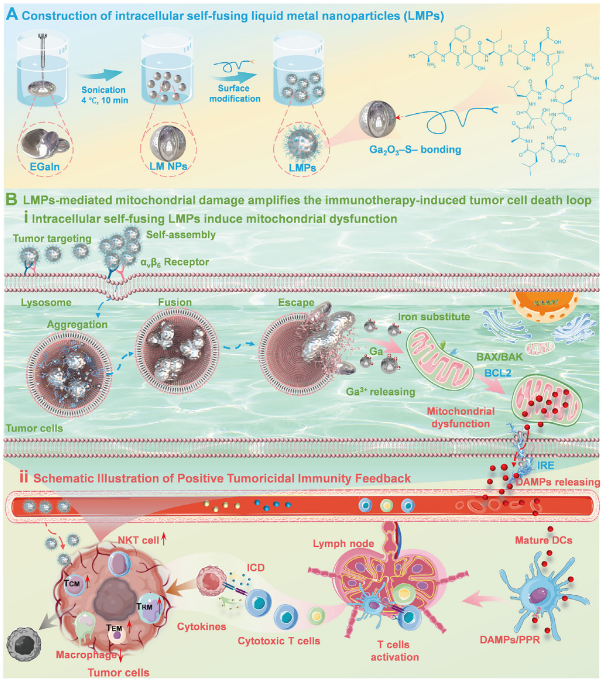
液态金属纳米颗粒(LMNPs)凭借其独特的自组装与细胞内融合特性,在肿瘤区域实现高效富集。其在癌细胞内释放的Ga³⁺能够竞争性取代铁离子,直接破坏线粒体功能,诱导肿瘤细胞死亡。当与不可逆电穿孔(IRE)技术联用时,这种线粒体靶向损伤被显著放大,使肿瘤细胞由“被动死亡”转变为“主动暴露”的免疫原性细胞死亡(ICD),释放大量危险信号(DAMPs)。这些信号有效激活树突状细胞,促进T细胞增殖与浸润,最终形成“杀伤—暴露—激活”的肿瘤免疫正向循环,为癌症免疫治疗开辟了“物理-化学-免疫”三重协同的全新策略。

在癌症治疗领域,科学家们不断探索新的方法来激活人体自身的免疫系统对抗肿瘤。其中,诱导免疫原性细胞死亡(ICD)是一种备受关注的策略,它能促使肿瘤细胞释放抗原和危险信号,从而激发强有力的抗肿瘤免疫反应。近期,一项发表在学术期刊上的研究提出了一种创新的方法,利用液态金属纳米颗粒来增强ICD,并与不可逆电穿孔技术结合,成功构建了一种高效的癌症疫苗疗法,为肿瘤免疫治疗提供了新的思路。
这项研究针对当前肿瘤疫苗面临的两大难题——肿瘤微环境的免疫抑制状态和肿瘤抗原免疫原性不足。研究团队设计并合成了一种特殊的液态金属纳米颗粒(LMPs)。这种颗粒表面修饰了靶向肽,能够特异性地识别并结合肿瘤细胞表面的整合素αvβ6受体。当大量LMPs聚集在细胞表面时,会启动自我组装过程,极大地提升了肿瘤细胞对它们的摄取效率。
进入细胞后,LMPs展现出其独特的行为。在酸性溶酶体环境中,这些纳米颗粒会发生融合,尺寸显著增大,从而延长了在细胞内的滞留时间。更重要的是,在融合过程中,液态金属会释放出镓离子。镓离子是铁离子的类似物,能够竞争性地干扰线粒体内铁硫簇的组装,破坏电子传递链,最终导致严重的线粒体功能障碍。线粒体损伤会引发一系列连锁反应,包括活性氧积累、线粒体DNA泄漏以及多种损伤相关分子模式的释放,这正是启动ICD的关键步骤。
然而,研究发现,仅靠LMPs诱导的ICD还不足以完全清除已形成的肿瘤。为此,团队引入了不可逆电穿孔技术作为物理辅助手段。IRE通过在肿瘤局部施加高强度电脉冲,不可逆地破坏细胞膜,导致细胞快速死亡,同时促使LMPs预先在细胞内积累的DAMPs和肿瘤抗原大量释放到肿瘤微环境中。这种“化学预激”与“物理触发”的结合,产生了显著的协同效应。
在肝癌小鼠模型中,这种联合疗法展现出了强大的抗肿瘤效果。与单独的LMPs或IRE治疗相比,联合治疗能更有效地抑制肿瘤生长,显著降低复发率,并大幅延长了小鼠的生存期。深入机制研究表明,该疗法不仅促进了树突状细胞的成熟和激活,还显著增加了肿瘤内CD8+组织驻留记忆T细胞和NK T细胞的浸润,同时重塑了免疫抑制性的肿瘤微环境。
尤为重要的是,这种疗法诱导了长期且特异性的抗肿瘤免疫记忆。当用相同肿瘤细胞再次攻击经联合治愈的小鼠时,它们表现出了强大的保护能力,肿瘤无法生长。而用其他类型肿瘤细胞攻击时,则无此保护作用,证明了免疫记忆具有肿瘤特异性。这相当于在体内接种了一剂“定制化”的肿瘤疫苗。
该研究通过巧妙的纳米设计,将液态金属的动态特性与免疫激活机制相结合,克服了纳米药物在肿瘤内富集与滞留时间之间的传统矛盾。它不仅为增强免疫原性细胞死亡提供了一种智能化的纳米诱导剂,也为未来开发基于原位肿瘤疫苗的联合免疫疗法奠定了坚实的理论和实验基础,展现出广阔的临床应用前景。
参考文献:
DOI: 10.1002/adma.202520580
- 上一款: ACS Nano | 含硒纳米尺度氢键有机框
- 下一款: Biomaterials | 用仿生纳米颗粒

 mxene 学术专题
mxene 学术专题