
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

研究背景
 Metal–Organic Framework Nanocarriers for Drug Delivery in Biomedical ApplicationsYujia Sun, Liwei Zheng, Yu Yang, Xu Qian, Ting Fu*, Xiaowei Li, Zunyi Yang, He Yan, Cheng Cui*, Weihong Tan* Nano‑Micro Lett.(2020) 12:103https://doi.org/10.1007/s40820-020-00423-3
Metal–Organic Framework Nanocarriers for Drug Delivery in Biomedical ApplicationsYujia Sun, Liwei Zheng, Yu Yang, Xu Qian, Ting Fu*, Xiaowei Li, Zunyi Yang, He Yan, Cheng Cui*, Weihong Tan* Nano‑Micro Lett.(2020) 12:103https://doi.org/10.1007/s40820-020-00423-3本文亮点
内容简介
湖南大学分子科学与生物医学实验室(MBL)团队等在本文中综述了MOFs的独特性质及其作为纳米药物载体在生物医学领域的应用。综述了利用表面吸附、孔包封、共价结合、功能分子作为构建基元等方法实现MOFs功能化的研究现状。随后介绍了MOFs在药物、蛋白质和核酸,特别是核酸适配体的细胞内传递方面的最新生物学应用。最后,本文对其面临的挑战和前景进行了全面的讨论,为MOFs作为高效药物传递系统的未来发展提供了背景。
图文导读
I MOFs简介及其在生物医学上的应用
金属-有机骨架(MOFs)以无机金属(如过渡金属和镧系金属)离子/团簇为节点,以有机配体(如羧酸盐、膦酸盐、咪唑酸盐和酚酸酯)为支撑,形成了扩展的无限一维/二维/三维MOFs网络。近年来,MOFs在生物医学领域的应用越来越受到人们的关注。当MOF粒子的尺寸缩小到纳米级时,这些纳米MOF(NMOFs)可以用于成像、化疗、光热治疗或光动力治疗的药物递送载体。与其它多孔材料相比,MOFs具有许多突出的优点,如:(1)具有高的比表面积和孔隙率,可用于高负载量的治疗药物;(2)易于通过无机团簇和/或有机配体对MOFs的物理(如孔径和形状)和化学性质进行改性。此外,通过对配体的预设计或合成后的修饰方法,可以在有机配体上添加所需的官能团;(3)通过MOFs的开放窗口和孔可以使扩散基质与结合分子发生相互作用;(4)中等强度的配位键,使MOF可生物降解;(5)明确的结构有利于主客体相互作用研究。由于这些独特的性质,MOFs被认为是药物传递和癌症治疗的最佳候选药物之一。II 药物递送的功能化MOFs具有独特的性质,如高度有序的结构、高比表面积和大孔容,使其能够在其外表面或开放通道上吸附功能分子,并将这些分子困在骨架内。此外,功能分子可以通过一锅法合成或合成后修饰,通过共价键结合到MOFs中。主要有四种先进策略可使具有生物应用治疗剂的MOFs功能化,包括:表面吸附、孔包封、共价结合和功能分子作为为构建模块。
 图1. a 以ZIF-70为基质,将MG和GDH共固定在电极表面制备葡萄糖电化学生物传感器的原理图。b ssDNA固定在精确控制通道大小的Ni-IRMOF-74系列中的示意图。镍、碳和氧原子分别用绿色、金色和红色标记。c 随着MOF通道大小的增加,ssDNA与MOFs相互作用逐渐增强。相对较弱的相互作用保证了ssDNA的吸收、保护和可逆释放。
图1. a 以ZIF-70为基质,将MG和GDH共固定在电极表面制备葡萄糖电化学生物传感器的原理图。b ssDNA固定在精确控制通道大小的Ni-IRMOF-74系列中的示意图。镍、碳和氧原子分别用绿色、金色和红色标记。c 随着MOF通道大小的增加,ssDNA与MOFs相互作用逐渐增强。相对较弱的相互作用保证了ssDNA的吸收、保护和可逆释放。
3.1 药物
通常,药物通过原位封装或合成后修饰策略负载到MOFs中。前者是一种相对简单的方法,适用于热稳定药物克服药物的过早释放。后者为避免破坏药物分子提供了更温和的环境。随着MOF化学的发展,已经探索了一系列MOFs作为在该领域中应用的有前途的候选载体。
 图2. a PAA@ZIF-8作为DOX载药和pH控制释放的纳米载体的综合示意图。b 负载DOX的PAA@ZIF-8在pH值为5.5和7.4、温度为37°C时的药物释放。c 不同浓度的PAA@ZIF-8、负载DOXPAA@ZIF、单药DOX孵育24 h后对MCF-7细胞的毒性。d MCF-7细胞对负载DOX PAA@ZIF-8([DOX]=20 μg/mL)分别在37℃下孵育3小时(A-C)、12小时(D-F)和24小时(g-I)的细胞摄取CLSM图像。1-3列可分别为细胞核(Hoechst 33342染色成蓝色),DOX负载PAA@ZIF-8,以及两者的合并图像。比例尺为10 μm。
图2. a PAA@ZIF-8作为DOX载药和pH控制释放的纳米载体的综合示意图。b 负载DOX的PAA@ZIF-8在pH值为5.5和7.4、温度为37°C时的药物释放。c 不同浓度的PAA@ZIF-8、负载DOXPAA@ZIF、单药DOX孵育24 h后对MCF-7细胞的毒性。d MCF-7细胞对负载DOX PAA@ZIF-8([DOX]=20 μg/mL)分别在37℃下孵育3小时(A-C)、12小时(D-F)和24小时(g-I)的细胞摄取CLSM图像。1-3列可分别为细胞核(Hoechst 33342染色成蓝色),DOX负载PAA@ZIF-8,以及两者的合并图像。比例尺为10 μm。
3.2 核酸
核酸包括脱氧核糖核酸(DNA)和核糖核酸(RNA)。核酸在遗传信息的存储和表达中起着重要的作用。总的来说,在MOFs纳米载体中加入核酸可以防止其降解并加速其细胞吸收。此外,用核酸对MOFs纳米粒子进行表面修饰,可以通过提供空间位阻和静电阻聚来提高其胶体稳定性。目前,MOFs已被研究用于DNA、小干扰RNA(siRNA)、核酸适配体的递送或者控制释放。
 图3. a pEGFP-C1@ZIF-8通过仿生矿化和pEGFP-C1@ZIF-8-聚合物通过共沉淀后的细胞摄取和表达的示意图。b 不同浓度的pEGFP-C1@ZIF-8、 pEGFP-C1@ZIF-8-PEI 25kD、lipofectamine-2000的转染效率。c 在MCF-7细胞中表达pEGFP-C1的典型CLSM图像。
图3. a pEGFP-C1@ZIF-8通过仿生矿化和pEGFP-C1@ZIF-8-聚合物通过共沉淀后的细胞摄取和表达的示意图。b 不同浓度的pEGFP-C1@ZIF-8、 pEGFP-C1@ZIF-8-PEI 25kD、lipofectamine-2000的转染效率。c 在MCF-7细胞中表达pEGFP-C1的典型CLSM图像。
3.3 蛋白
蛋白具有很多功能,如DNA复制、代谢反应的催化、分子运输等。由于蛋白质体积大、表面带电、对环境敏感,蛋白质很难在不丧失结构完整性的情况下自然穿过细胞膜。为了将蛋白质用于治疗目的,近年来,用于蛋白质胞内传递的MOFs纳米颗粒引起了越来越多的关注。
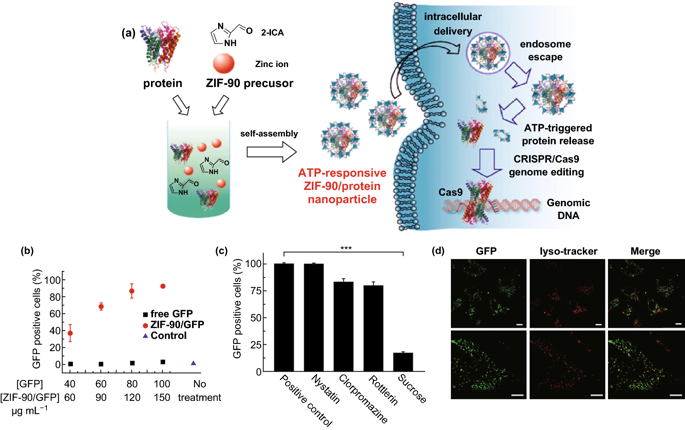 图4. a ZIF-90/蛋白纳米粒的合成和ATP在细胞内触发蛋白释放的示意图。b ZIF-90/GFP的细胞摄取效率。c 不同的内吞抑制剂对ZIF-90/GFP细胞摄取效率的影响。d ZIF-90/GFP处理HeLa细胞的CLSM图像。用溶酶体探针(红色)进行内含体/溶酶体染色。IV 挑战尽管MOFs在药物递送领域的应用取得了显著的成就,但在这一领域仍然存在着一些挑战:1)到目前为止,对药物的载药和释放动力学的研究还很有限;2)基于MOF的DDS在临床应用上的潜在毒性。现有文献对MOF纳米粒的毒性研究非常有限,不足以得出结论。为了达到MOF纳米粒的临床开发阶段,应通过对其稳定性、降解机理和对正常器官的副作用进行系统的体内研究,优化基于MOFs的DDS的临床前评价性能。
图4. a ZIF-90/蛋白纳米粒的合成和ATP在细胞内触发蛋白释放的示意图。b ZIF-90/GFP的细胞摄取效率。c 不同的内吞抑制剂对ZIF-90/GFP细胞摄取效率的影响。d ZIF-90/GFP处理HeLa细胞的CLSM图像。用溶酶体探针(红色)进行内含体/溶酶体染色。IV 挑战尽管MOFs在药物递送领域的应用取得了显著的成就,但在这一领域仍然存在着一些挑战:1)到目前为止,对药物的载药和释放动力学的研究还很有限;2)基于MOF的DDS在临床应用上的潜在毒性。现有文献对MOF纳米粒的毒性研究非常有限,不足以得出结论。为了达到MOF纳米粒的临床开发阶段,应通过对其稳定性、降解机理和对正常器官的副作用进行系统的体内研究,优化基于MOFs的DDS的临床前评价性能。
文章来源纳微快报 nanomicroletters
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫