肿瘤免疫治疗因其疗效高、副作用小,近年来在临床试验中得到广泛研究。然而,免疫反应制剂通常需要高剂量以确保免疫治疗效果,这不可避免的会引起全身免疫激活等一系列副作用;近年来,许多科研工作者尝试采用纳米系统用于免疫反应制剂的递送。但是,用于构建纳米系统的无机类载体的安全性和毒性仍然存在一些需要克服的挑战。因此,为促使纳米输送系统相关研究尽快走向临床转化,使用临床批准的材料可能是未来各种肿瘤模型的可行选择。
Artificial Nanoscale Erythrocytes from Clinically Relevant Compounds for Enhancing Cancer ImmunotherapyWenquan Ou, Kang Sik Nam, Dae Hoon Park, Jungho Hwang*, Sae Kwang Ku, Chul Soon Yong, Jong Oh Kim*, Jeong Hoon Byeon*Nano‑Micro Lett.(2020) 12:90https://doi.org/10.1007/s40820‑020‑00428‑y
1. 设计了一种两相同轴电喷雾法制备紫杉醇负载的假血细胞微粒。2. 联合抗程序性死亡配体1抗体(Eu-FBCP/PTX+aPL)可进一步提高化疗免疫疗效。
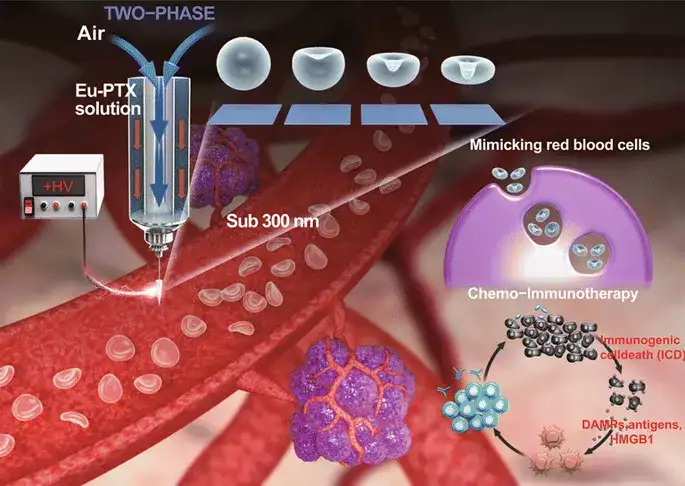
目前,临床批准的聚合物药用树脂-聚丙烯酸树脂(Eudragit®[Eu])作为仿生纳米系统,可有效地携带抗程序性死亡配体(PD-L1)的抗体(aPL)。本研究开发了一种气-液两相电喷雾,在喷雾的机械参数和电气参数平衡的情况下,可以连续产生仅由临床相关化合物组成的仿生纳米系统[负载紫杉醇的假血细胞聚丙烯酸树脂(Eu)颗粒(Eu-FBCP/PTX)],此系统为实现临床转化的化学-免疫治疗纳米系统的发展提供了一个概念上的飞跃。Eu-FBCP/PTX纳米系统表现出吞噬和大胞饮的细胞摄取行为;在没有和存在抗PD-L1抗体的情况下,比类似大小的负载PTX的球形Eu颗粒(Eu-s/PTX)在化学-免疫治疗中具有更好的疗效。
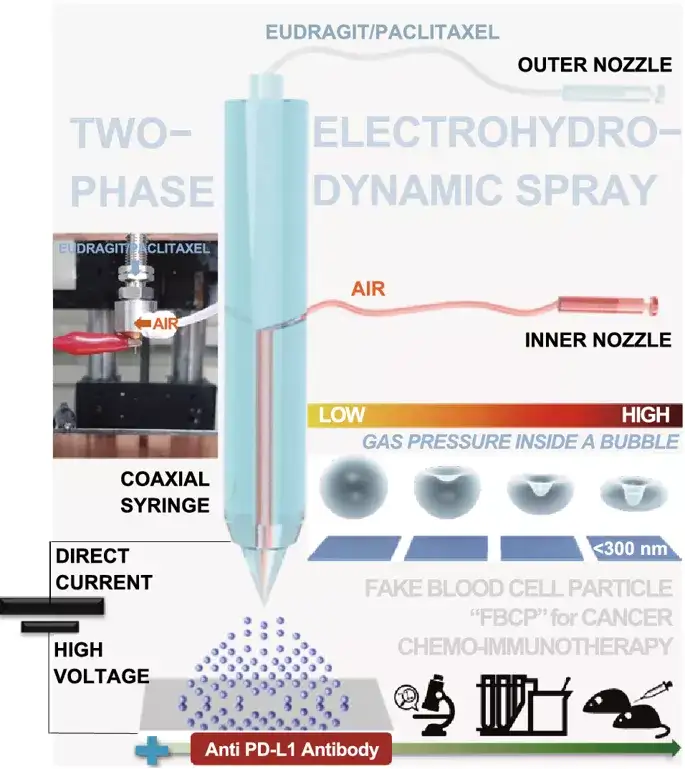
采用气泡压缩法生成Eu-FBCP/PTX的凹面结构。所设计的两相电喷雾成功地制备了凹形结构,这意味着干燥Eu溶质的气泡压制可以克服粘性力和表面张力(最好形成球形)而产生各向异性形状。用Cy5.5标记的纳米系统孵育MC-38和B16BL/6肿瘤细胞,来检测Eu-FBCP/Cy5.5和Eu-s/Cy5.5之间的细胞摄取差异。结果显示,Cy5.5标记的Eu(RL)纳米系统在MC-38和B16BL/6细胞中的细胞摄取量均显著低于Eu-FBCP/Cy5.5或Eu-s/Cy5.5的细胞摄取量。Eu-FBCP/PTX的粒径平均为320.8nm。Eu-FBCP/PTX纳米系统在48小时内的分散具有时间依赖的缓释特性(匹配HIGUCHI模型)。
图1.空气(内喷嘴)-液体(外喷嘴;乙醇中的Eu/PTX)两相电喷雾示意图。它可以在电(BE)和机械(CaRe)参数之间的平衡下,利用Eu/PTX熔体在干燥液滴中的气泡加压产生凹面(模仿血细胞形状)颗粒(Eu FBCP/PTX),用于联合抗程序性死亡配体1(PD-L1)抗体(aPL)的化学免疫治疗。使用单相(仅适用于Eu/PTX溶液)电喷雾产生类似大小的球形颗粒(Eu-s/PTX),以便在不存在aPL的情况下进行比较。
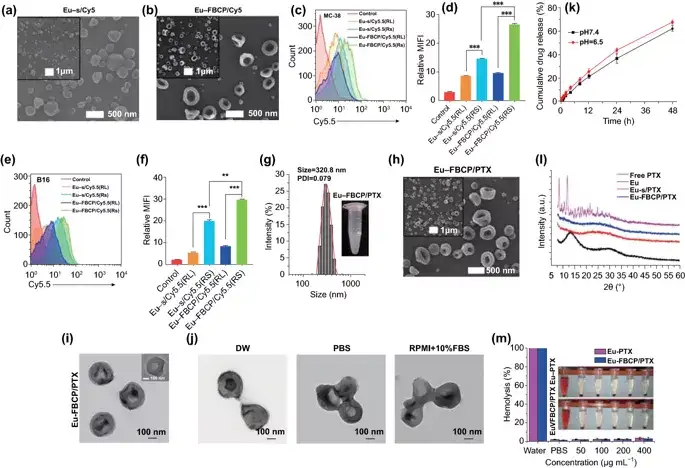
图2. PTX不存在时Eu-FBCP和Eu-s的表征。a,b Eu-s/Cy5.5和Eu-FBCP/Cy5.5的高、低倍扫描电镜图像。通过控制乙醇溶液中Eu的浓度,在不向内喷嘴喷射空气的情况下,制备了尺寸相近的Eu-s/Cy5.5。c-f FACS结果(n=3;荧光曲线和平均荧光强度[MFI])用于比较电喷雾中添加Cy5.5后Eu-FBCP和Eu-s之间MC-38(c,d)或B16(e,f)细胞的摄取,以检查Eu-FBCP因凹形而产生更好的摄取。该分析包括Eu-RL,以确认Eu-RS和Eu-RL之间的吸收差异,为选择Eu-RS提供依据。g Eu-FBCP/PTX在PBS(嵌入数字图像)中的DLS尺寸分布和PDI。h,i Eu-FBCP/PTX的高、低倍扫描电镜(h)和透射电镜(i)图像。j Eu-FBCP/PTX在DW、PBS或RPMI+10%FBS中分散8h后的典型TEM图像研究不同介质的水动力稳定性。k在pH6.5或pH7.4(n=3)条件下,从Eu-FBCP/PTX中释放PTX 48小时。i Eu-FBCP/PTX和Eu-s/PTX以及游离PTX和Eu(RS;电喷雾前)的XRD谱图,考察并比较Eu和PTX的掺入情况。m 用不同浓度的Eu-FBCP/PTX或Eu-s/PTX(50-400μg mL-1)培养红细胞8小时后溶血结果(n=3;**p<0.01 and **p< 0.001)。
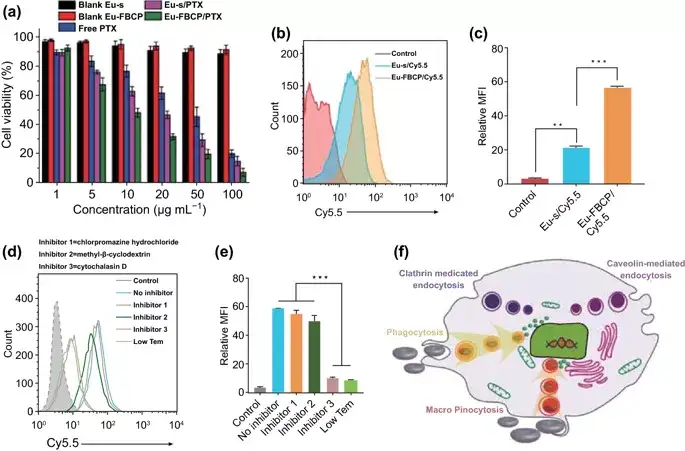
MTT结果显示,Eu-FBCP和Eu-s(在没有PTX的情况下)均表现出高细胞活性(>95%),而游离PTX诱导剂量依赖性细胞毒性,显示出28.4μg mL-1的最大半数抑制浓度(IC50)。Eu-s/PTX,Eu-FBCP/PTX的最大半数抑制浓度分别为15.9和9.7μg mL-1,均显著低于游离的PTX。研究显示,Eu-FBCP/Cy5.5的细胞摄取较Eu-s/Cy5.5增加了3倍且Eu-FBCP/Cy5.5主要通过吞噬和大胞饮途径进入细胞。
图3. Eu-FBCP/PTX处理MC-38细胞的体外生物测定结果及可能机制。(**p<0.01 and **p<0.001)。a 用Eu-FBCP/PTX或Eu-s/PTX处理MC-38细胞24小时,以及游离PTX和单个Eu-FBCP或Eu-s(n=6)。b,c 比较Eu-FBCP/Cy5.5和Eu-s/Cy5.5细胞摄取的FACS结果(n=3;荧光谱和MFI)。d,e FACS结果(n=3;荧光谱和MFI)用于比较不同抑制剂(包括低温条件)预处理对Eu-FBCP/Cy5.5细胞摄取的影响。f 不同抑制剂预处理细胞并随后与Eu-FBCP/Cy5.5孵育的摄取途径的机制示意图。
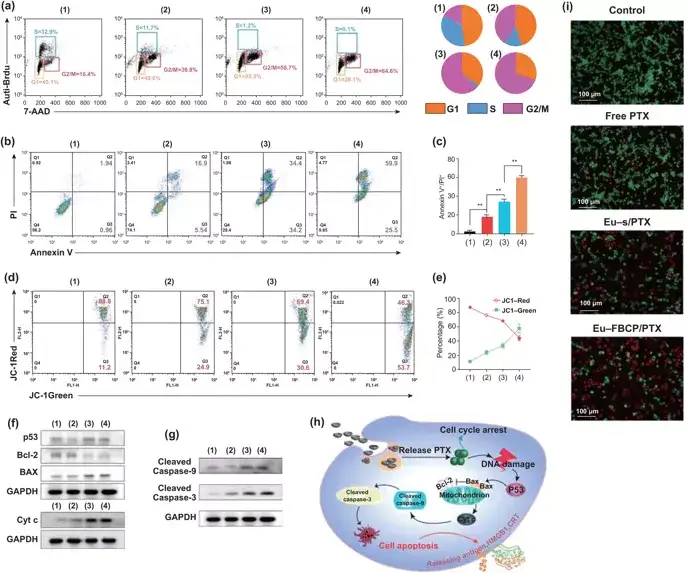
Eu-FBCP/PTX诱导85.4%的细胞凋亡(早期和晚期:Q2+Q3),比Eu-s/PTX诱导的细胞凋亡率高16.8%。线粒体膜电位 (ΔΨm)的丧失是Cyt c从线粒体向胞浆转运的重要标志,是凋亡程序的开始。Eu-FBCP/PTX纳米系统较其它药物组有更强的线粒体损伤效果。
图4. 不同组别的MC-38细胞的体外细胞周期和凋亡分析(1:对照,2:游离PTX,3:Eu-s/PTX,4:Eu-FBCP/PTX)。a 不同处理(1-4)的细胞周期分析结果。Brdu和PI用于计算细胞周期中每个阶段(G1、S或G2/M)的细胞分数。b,c 使用Annexin V-FITC/PI试剂盒(n=3)对24小时治疗(1-4)的凋亡情况和量化数据进行分析。d,e 处理24小时后,细胞的 FACS曲线和JC-1染色的量化数据显示(1-4)细胞(n=3)线粒体膜电位的变化。f,g p53、Bcl-2、Bax、Cyt-c、裂解caspase-9和裂解caspase-3在治疗细胞(1-4)中的代表性表达。h 基于表达(f, g)的治疗细胞(1-4)凋亡的可能机制示意图。i 处理后活/死细胞实验的代表性显微镜AO/PI染色细胞图像(1-4)。
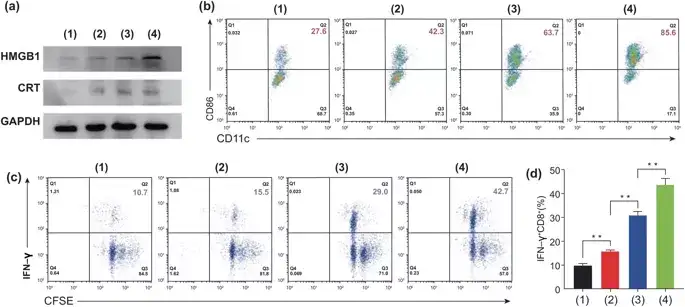
PTX可以通过释放肿瘤抗原,如HMGB1、CRT和ATP,从死亡细胞表面诱导免疫原性细胞死亡(ICD)。HGMB1和CRT的分泌是促使树突状细胞(DCs)成熟并引发ICD的关键因素。用Eu-FBCP/PTX处理细胞后,HMGB1和CRT的表达要远远高于Eu-s/PTX组或者游离的PTX组。这些分子作为DC成熟的辅助刺激物,诱导了85.6%的成熟DC,比Eu-s/PTX(63.7%)诱导的成熟DC多21.9%,比游离PTX(42.3%)诱导的成熟DC多2倍以上。这些结果显示,Eu-FBCP/PTX处理细胞后能最大限度地提高CRT和HMGB1的表达,促进DCs的成熟和IFN-γ+CD8+T细胞的活化。
图5. 不同方法处理后,对MC-38细胞进行体外生物测定,以检测ICD诱导的的DC细胞成熟和CD8+T细胞活化。1:对照组,2:游离PTX,3:Eu-s/PTX和4:Eu-FBCP/PTX)。a 治疗组(1-4)HMGB1和CRT的代表性表达,显示ICD的诱导。b 处理细胞后(1–4)CD11c+–CD86+(作为DC成熟的指标)通过产生的TAA来识别DC的成熟。c CFSE-IFN-γ检测CD8+T细胞的增殖和活化。d 处理细胞后(1-4)活化的IFN-γ+CD8+T细胞。
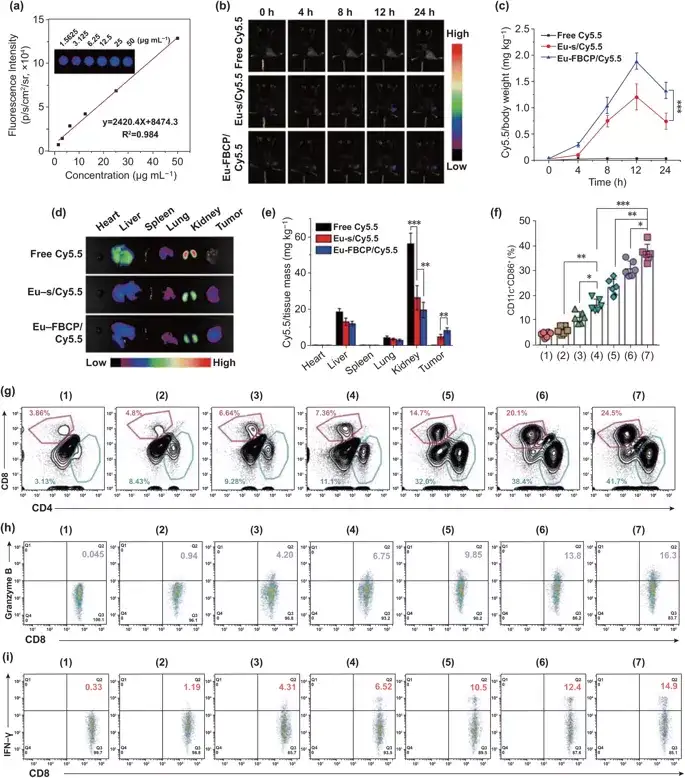
小鼠静脉注射12h内,肿瘤部位的荧光强度逐渐增加,24h后荧光强度开始降低,其中,注射Eu-FBCP/Cy5.5组的肿瘤部位荧光强度是Eu-s/Cy5.5组的1.76倍。
图6. Eu-FBCP/Cy5.5(或Eu-s/Cy5.5)的体内生物分布及不同处理(1:PBS,2:游离PTX,3:Eu-s/PTX,4:Eu-FBCP/PTX,5:aPL,6:Eu-s/PTX+aPL,7:Eu-FBCP/PTX+aPL)的抗肿瘤免疫反应。a 体内处理后,使用动物成像系统获得浓度范围为1.5625至50.0000微克/毫升的荧光Cy5.5的校准曲线。b 荧光时间影像(0、4、8、12和24小时)检测Eu-FBCP/Cy5.5和Eu-s/Cy5.5以及游离Cy5.5在静脉注射后的肿瘤蓄积情况。c 不同时间点的Cy5.5在肿瘤中的分布。d,e 静脉注射24小时后小鼠主要器官和肿瘤的典型荧光图像和量化数据。f 不同处理方法静脉注射树突状细胞瘤内成熟(1-7)(n =6; *p< 0.05,**p< 0.01, and ***p< 0.001)。g 药物处理后CD4+–CD8+T细胞浸润到肿瘤微环境中(1-7)。g,i 药物处理后肿瘤内浸润CD8+T细胞CD8+–颗粒酶B+和CD8+–IFN-γ+水平图(1-7)。
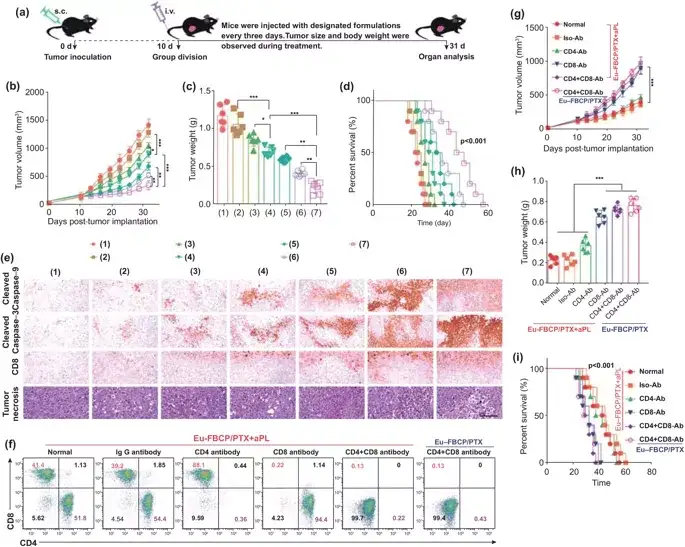
为了证实Eu-FBCP/PTX纳米系统在ICD诱导的免疫治疗中的重要作用,进一步构建了相关的体内模型,以检测在aPL不存在和存在的情况下,DCs的成熟和抗肿瘤IFN-γ+CD8+T细胞的活化。实验结果显示,EuFBCP/PTX诱导的ICD可增强aPL的抗肿瘤免疫反应,诱导大量活化的CD8+T细胞对抗MC-38肿瘤。VII 体内联合抗肿瘤作用受Eu-FBCP/PTX与aPL联合激活抗肿瘤免疫反应的启发,对MC-38荷瘤免疫活性C57BL/6小鼠进行了联合治疗的疗效评价。在没有aPL的情况下,Eu-FBCP/PTX和Eu-s/PTX可以提高PTX的疗效并适度地抑制肿瘤的生长。而Eu-FBCP/PTX + aPL可以显著地抑制肿瘤的生长,并且给药后对小鼠的体重基本无影响,较其它实验组的小鼠的寿命更长,证实了此纳米系统较好的疗效和生物安全性。进一步的实验验证了此系统中,ICD的诱导和抗肿瘤免疫应答在治疗中的重要作用。
图7. Eu-FBCP/PTX和Eu-s/PTX在aPL缺乏(诱导化学ICD)和存在(增强免疫抗肿瘤活性)情况下的体内抗肿瘤作用(*p< 0.05, **p<0.01, and ***p <0.001)。a 不同处理(1:PBS、2:游离PTX、3:Eu-s/PTX、4:Eu-FBCP/PTX、5:aPL、6:Eu-s/PTX+aPL和7:Eu-FBCP/PTX+aPL)体内抗肿瘤研究的实验时间表示意图。b, c从治疗小鼠(1-7;每组6只)收集的肿瘤大小和肿瘤最终重量的时间分布。d治疗小鼠的存活曲线(1-7;每组10只)。e在从治疗小鼠(1-7只,每组6只)获得的肿瘤切片中,切割的caspase-9、切割的caspase-3、CD8+和肿瘤坏死因子的组织病理学和免疫组化表达。f用PBS(正常)、IgG抗体(Iso-Ab)、CD4抗体(CD4-Ab)、CD8抗体(CD8-Ab)和CD8+CD4抗体(CD4+CD8-Ab)预处理后免疫细胞生成,构建免疫组化MC-38荷瘤小鼠模型。g, h单独用Eu-FBCP/PTX+aPL或Eu-FBCP/PTX治疗的免疫组化小鼠(每组6只)的肿瘤大小和最终肿瘤重量的时间分布。i单独用Eu-FBCP/PTX+aPL或Eu-FBCP/PTX治疗的免疫复合小鼠的存活曲线(每组10只)。
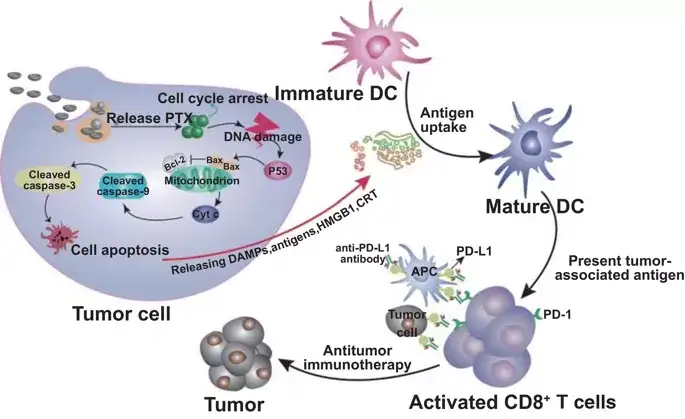
图8. 通过将Eu-FBCP/PTX与aPL结合,从Eu-FBCP/PTX诱导的ICD中促进疗效的可信模型示意图。Eu-FBCP/PTX通过吞噬和大胞饮作用进入肿瘤细胞释放PTX,诱导细胞周期G2/M期和内源性凋亡。凋亡癌细胞释放HMGB1和CRT,促进DC成熟和CD8+T细胞活化。Eu-FBCP-PTX诱导的ICD进一步促进了aPL的疗效,其仿生性能优于Eu-s/PTX。
本信息源自互联网仅供学术交流 ,如有侵权请联系我们立即删除。