
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

本研究开发了一种磁性双特异性纳米抗体(M-BiNanoAb),可通过静脉给药在体内与循环T细胞结合,将其原位改造为具备靶向与杀伤功能的CAR-T模拟细胞。该纳米抗体表面同时修饰抗CD3和抗PD-L1抗体,可分别模拟CAR结构的信号域与抗原识别域,使T细胞获得特异性识别并清除PD-L1高表达肿瘤细胞的能力。尤为关键的是,借助外部磁场引导,这些工程化细胞能够定向迁移并有效浸润至实体瘤内部,显著提升了肿瘤微环境中的T细胞聚集与活化水平。在黑色素瘤和乳腺癌等多种临床前模型中,该策略展现出超过90%的肿瘤抑制率,并能激发抗原表位扩散与长效免疫记忆,为实体瘤的免疫治疗提供了兼具靶向性、可控性与强效性的新途径。

在癌症免疫治疗的探索中,CAR-T细胞疗法已在血液肿瘤领域取得突破,但其在实体瘤治疗中的应用仍面临诸多挑战,尤其是T细胞难以有效浸润至肿瘤内部以及肿瘤微环境的免疫抑制特性。最近,一项创新研究提出了一种名为“磁性双特异性纳米抗体”的新策略,有望在体内直接生成并精准操控类CAR-T细胞,为实体瘤治疗开辟了新路径。
该研究团队设计了一种磁性双特异性纳米抗体,简称为M-BiNanoAb。其核心是以β-环糊精功能化的磁性纳米颗粒为基础,通过超分子作用同时搭载抗CD3抗体和抗PDL1抗体。当M-BiNanoAb通过静脉注射进入体内后,其抗CD3部分能精准识别并结合血液循环中的T细胞,使其在原位被“改造”为具有类似CAR-T细胞功能的效应细胞;而抗PDL1部分则模拟了传统CAR结构中的抗原识别域,能够靶向结合肿瘤细胞表面高表达的PDL1分子。更重要的是,借助外置磁场的引导,这些经过工程化改造的T细胞能够被定向驱动至肿瘤部位,显著增强其在肿瘤组织中的浸润与聚集。
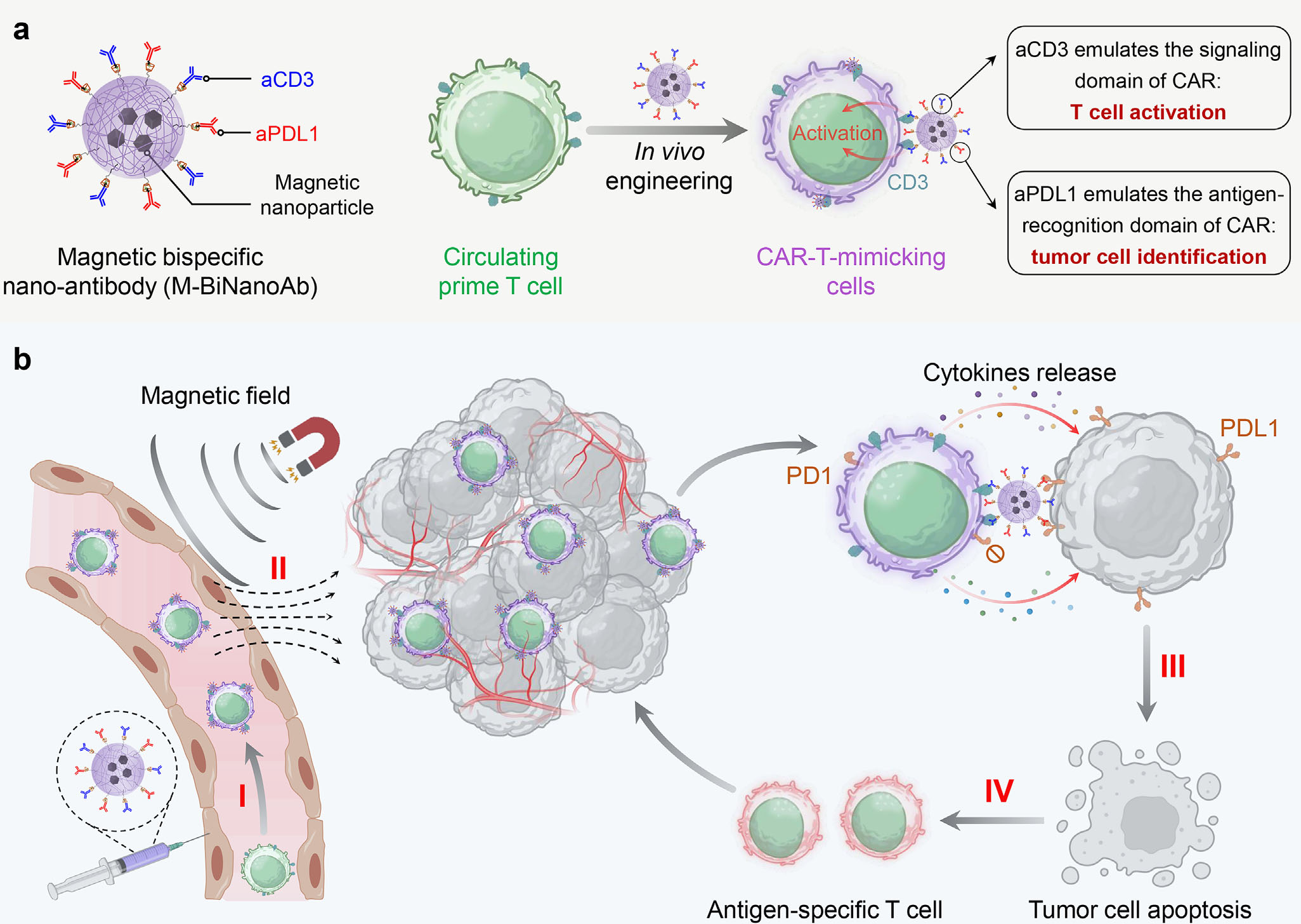
在临床前实验中,这种策略展现了强大的抗肿瘤潜力。研究发现,经M-BiNanoAb改造的类CAR-T细胞不仅能高效识别并杀死高表达PDL1的肿瘤细胞,还能在外加磁场指导下实现定向迁移,有效克服了血流剪切力的影响,并大量聚集于肿瘤内部。在黑色素瘤和乳腺癌等多种实体瘤模型中,磁导的M-BiNanoAb治疗方案实现了超过90%的肿瘤抑制率,并能显著延长小鼠的生存期。此外,该策略还能缓解T细胞在肿瘤微环境中的耗竭状态,并促进干细胞样记忆T细胞的生成,从而有望建立起长效的抗肿瘤免疫记忆。
除了直接的杀伤效果,该研究还观察到治疗后出现的“表位扩散”现象。即在清除原靶点肿瘤细胞的过程中,其他肿瘤相关抗原被释放并提呈,从而激活内源性T细胞针对更多样抗原的免疫应答,这有助于对抗肿瘤的异质性。在肿瘤再挑战实验中,经过治疗的小鼠显示出强烈的免疫记忆保护效应,能够几乎完全抑制二次肿瘤的生长。
总体而言,M-BiNanoAb平台代表了一种简洁而高效的体内T细胞工程化策略。它巧妙地融合了超分子组装、抗体靶向与磁导航技术,为改善CAR-T细胞在实体瘤中的浸润性和持久性提供了创新解决方案。该技术的模块化设计也暗示着其潜在的扩展性,未来或可适配于其他免疫细胞或靶点,推动下一代肿瘤免疫治疗的发展。尽管走向临床仍需进一步的大动物安全性验证与技术优化,但这一研究无疑为攻克实体瘤治疗难题带来了新的曙光。
参考消息:
DOI: 10.1002/adma.202520493
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫