
咨询热线:
17715390137
18101240246
18914047343
邮件:mxenes@163.com
扫码关注或微信搜索公众号:
二维材料Fronrier
关注后点击右下角联系我们,
进入企业微信。
专业服务在线

本文精选
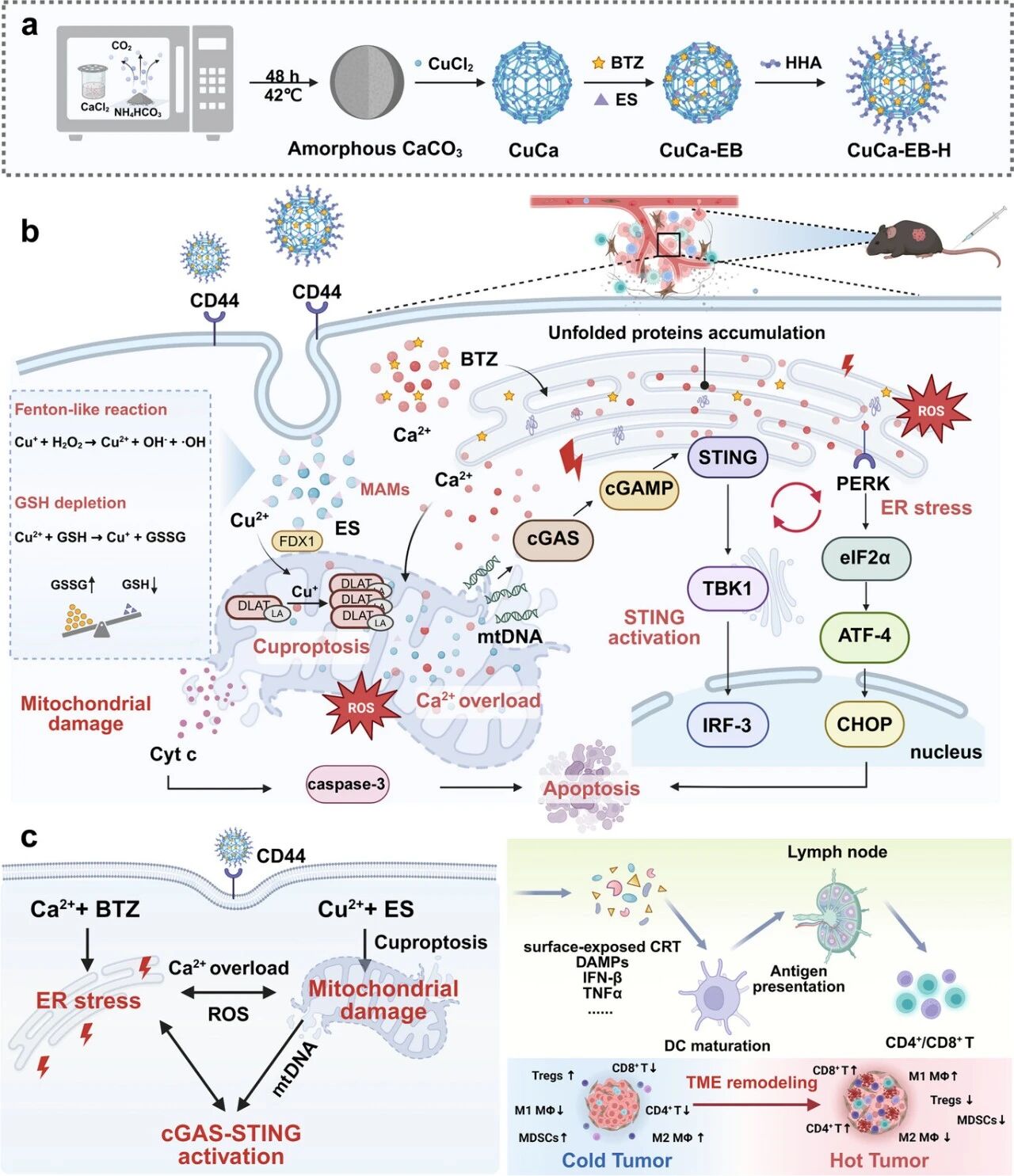
离子稳态破坏为抗肿瘤免疫提供了潜力,但由于难以获得强健的免疫原性以及分子机制模糊,其治疗效果仍不令人满意。本文介绍了一种针对肿瘤的笼状纳米药物(CuCa-EB‐H),即透明质酸装饰蛋白酶体抑制剂硼替佐米(BTZ)/铜离子团 elesclomol(ES)负载的铜钙双金属纳米笼,旨在解锁调控内质网(ER)应激和线粒体功能障碍以诱导抗肿瘤免疫的机制。具体来说,BTZ 和外源 Ca2 ⁺过载会引发内质网应激,不仅诱导内质网方铁网蛋白在细胞表面的转位,还会引发大量内源性 Ca 2+逸出并传递到线粒体,从而加剧线粒体 Ca2+过载。同时,ES 介导线粒体中 Cu 2+的靶向递送和积累,诱导铜管变形,进一步加剧线粒体损伤并促进线粒体 DNA 释放,从而激活 cGAS–STING 通路,从而产生内网压力介导的抗肿瘤免疫。此外,铜管生作用与这些过程协同,放大损伤相关分子模式的释放,表现出强健的免疫原性效应。CuCa-EB-H 纳米药物共同建立了内质网压力-线粒体功能障碍-STING 激活的互惠自我强化级联反应,显著刺激树突状细胞成熟,增加效应 T 细胞浸润,并逆转免疫抑制性肿瘤微环境。本研究为离子干扰免疫疗法提供了机制性见解,并提供了加强免疫检查点治疗的有前景策略。
创新点
1.本文的核心创新在于构建了一种独特的“离子干扰-细胞器协同-免疫激活”级联体系,首次将铜/钙双金属离子稳态干扰、蛋白酶体抑制诱导的内质网应激、以及线粒体靶向的铜死亡三者整合于一个智能纳米笼平台,实现了多靶点、自放大的抗肿瘤免疫激活,超越了单一离子干扰或细胞器靶向策略的局限性。
2.研究在机制上揭示了内质网与线粒体之间通过钙离子流形成的功能耦合与恶性循环,即内质网应激不仅引发自身免疫原性暴露,还通过钙信号导导致线粒体钙过载,进而与铜死亡协同诱导线粒体损伤和mtDNA释放,最终汇聚于cGAS-STING通路进行持续放大,这一“ER-线粒体-STING”轴的正反馈循环是此前研究中未被清晰阐明的创新性机制。
3.该工作的应用创新体现在设计了具有肿瘤靶向(透明质酸修饰)和双重药物负载(BTZ和ES)功能的双金属纳米笼,它不仅实现了药物的协同递送与时空控制释放,更通过材料自身(铜钙)的生物学活性成为治疗效应的直接参与者,为开发兼具载体功能与治疗功能的“一体式”纳米药物提供了新颖的设计范式。
思路延伸
1.基于“细胞器间协同致死”的思路,未来研究可进一步探索其他细胞器组合的靶向策略,例如,同步诱导溶酶体膜透化与线粒体损伤以释放更多水解酶和损伤信号,或设计同时干扰高尔基体功能和内质网稳态的纳米药物,以期发现新的免疫原性死亡触发路径。
2.在机制层面,可深入探究由该纳米药物触发的线粒体DNA释放的具体形式、时空动力学及其下游信号细节,例如研究其是否同时激活AIM2炎症小体等其它胞质核酸传感通路,并解析不同信号通路间的交叉对话如何共同塑造最终的抗肿瘤免疫图谱。
3.应用延伸方面,可考虑将此纳米平台与多种免疫调节剂(如细胞因子、肿瘤疫苗)或物理疗法(如光热、放疗)相结合,利用其已建立的免疫敏感微环境,进一步强化全身性抗肿瘤免疫应答。同时,探索该策略在克服免疫抑制性强的实体瘤(如胰腺癌、胶质母细胞瘤)治疗耐药性方面的潜力。
Original link
Cage-Like Nanodrug Potentiates Tumor Immunotherapy by Orchestrating Endoplasmic Reticulum–Mitochondrial Crosstalk
Advanced Functional Materials ( IF 19 )
Pub Date : 2025-12-30
DOI: 10.1002/adfm.202527957
Mofan Xiao, Junmin Qian, Huichen Zhao, Xinyu Li, Chenyang Liu, Jingjing Fan, Yuhan Li, Weijun Xu, Yaping Wang, Jinlei Wang, Xiaobing Chen, Aili Suo
 |
 |
 |
 |
| 二维材料Frontier | 生物纳米材料前沿 | MXenes Frontier | 纳米医学Frontier |
|
版权所有 © 2019 北京北科新材科技有限公司
All rights reserved. 京ICP备16054715号-2 |
扫一扫